Этаден – эффективный стимулятор репаративных процессов. Репарация ткани и раковое перерождение
ВВЕДЕНИЕ.
Целью данного реферата является сравнение двух процессов - процесса злокачественного перерождения ткани и процесса репаративной регенерации. На первый взгляд в них нет ничего общего, хотя наверняка это не так.
Мой реферат будет состоять из трех частей - в первой и второй частях я опишу сущность процессов репарации и онкогенеза, влияющие на эти процессы факторы, некоторые основные понятия связанные с этими явлениями. В последней, третьей части я попытаюсь сравнить некоторые явления и процессы, имеющие место быть в том или другом случае.
Начать следует с основных понятий:
«РЕГЕНЕРАЦИЯ (позднелатинское regeneratio – возрождение, восстановление) – обновление структур организма в процессе жизнедеятельности и восстановление структур, утраченных в результате патологических процессов. Различают физиологическую и репаративную регенерацию.
Физиологическая регенерация – непрерывное обновление структур на клеточном (смена клеток крови, эпидермиса, печени и д.р.) и внутриклеточном (обновление клеточных органелл) уровнях, благодаря чему обеспечивается функционирование органов и тканей.
Репаративная регенерация – процесс ликвидации структурных повреждений после действия патогенных факторов. В ее основе лежат такие же механизмы, как и при физиологической регенерации, она отличается лишь большей интенсивностью проявлений. Репаративную регенерацию, в процессе которой восстанавливается ткань, идентичная погибшей, называется полной, или реституцией. В ряде случаев в результате репаративной регенерации в зоне повреждения образуется не специфическая для данного органа ткань, а рубец – неполная регенерация или субституция. При некоторых состояниях организма (гиповитаминозе, истощении и д.р.) течение репаративной регенерации бывает затяжным, качественно извращенным (сопровождается образованием длительно незаживающих язв, формирование ложного сустава и д.р.), то есть наблюдается патологическая регенерация.
Процесс регенерации происходит на всех уровнях – органном, тканевом, клеточном, внутриклеточном. Осуществляется он путем деления клеток, обновления внутриклеточных структур и их размножения.
ОНКОГЕНЕЗ представляет собой длительный и многостадийный процесс, состоящий из совокупности событий, которые в экспериментальных моделях разделяют на стадии инициации, промоции и прогрессии . Хотя концепция многостадийности онкогенеза была разработана исходя из результатов опытов с использованием лабораторных животных, считается, что у человека опухолевый процесс развивается подобным образом. Согласно существующим представлениям, неопластическое перерождение ткани может происходить в результате генетических изменений в одной клетке, которая в результате митотического деления дает начало клону клеток, имеющих трансформированный фенотип. Эти клетки претерпевают множественные изменения, прежде чем стать опухолевыми, и каждая из стадий онкогенеза характеризуется определенными фенотипическими, генотипическими и биохимическими особенностями.
РАКОВОЕ ПЕРЕРОЖДЕНИЕ.
ОНКОГЕНЫ, ПРОТООНКОГЕНЫ, АНТИОНКОГЕНЫ.
Во всех нормальных клетках есть гены, близкие по структуре к вирусным онкогенам, они были названы протоонкогенами. Эти гены регулируют нормальное поведение клетки – ее ответ на ростовые факторы, на гормоны, нормальный темп и «расписание» делений. Протоонкогены находятся под тщательным и жестким контролем других генов. Мутации протоонкогенов выводят их из-под воздействия контролирующих генов, делают их автономными. Как правило, воздействие различных канцерогенных факторов приводит к постоянной активности протоонкогена. Так хромосомные транслокации ведут к тому, что потоокоген попадает под контроль постоянно действующего в данной ткани гена, и он работает непрерывно, не давая клетке выйти из цикла делений (myc), или посылая непрерывные сигналы с мембраны в ядро(ras) , или приводя к синтезу ростовых факторов, посылающих для той же клетки сигналы к делению (аутокринная стимуляция). Канцерогенные вещества и облучение обладают высокой мутагенной активностью, они вызывают изменения во многих генах, в том числе и в протоонкогенах. Эти мутации могут вести либо к нарушению регуляции протоонкогена, и тогда он выходит из-под контроля, либо к изменению свойств белка, контролируемого этим геном. Мутировавшие онкогены могут вызывать синтез онкобелка с измененными свойствами, и этот белок вызывает уже те процессы, которые определяют характерное асоциальное поведение клетки.
Итак, общим звеном в возникновении опухолей является онкоген, внесенный в клетку вирусом, или возникший из протоонкогена, а результате мутации, или выведенной из-под контроля сдерживающих генов хромосомной транслокации. Но в последние годы найдено еще одно звено, по-видимому, наиболее общее звЕно канцерогенеза – гены-супрессоры опухолей, подавляющие активность онкогенов. Главный представитель антионкогенов - р53 , названный по продукту от р-protein, и 53 – тк вес 53000 дальтон.
Было показано, что накопление продуктов нормального гена р53 останавливает прохождение клеткой митотического цикла на границе G1 и S . в результате поврежденная клетка не может удвоить поврежденную ДНК и передать геном своим клеткам-потомкам при делении. У клетки есть спец ферменты, ремонтирующие испорченную ДНК. Если через какое-то время повреждение исправлено, то вызванный р53 блок деления снимается, и клетка может вновь размножаться. Если повреждение ДНК не исправлено, тор53 включает программу апоптоза.
БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
ОПУХОЛЕВЫХ КЛЕТОК.
Самой характерной биологической особенностью опухолевых клеток является их автономность – независимость темпа размножения и других проявлений их жизнедеятельности от внешних воздействий (по отношению к клеткам), изменяющих и регулирующих жизнь нормальных клеток. Неправильно считать автономность абсолютной, понимать ее как полную независимость опухоли - любое новообразование сохраняет ту или иную степень зависимости от воздействующих на него факторов.
Также признаком многих, особенно злокачественных, опухолей я является анаплазия ткани, возвращение ее к более примитивному типу.
Для морфологической анаплазии характерна утрата опухолевой тканью особенностей, характерных для исходных дифференцированных тканей. Степень анаплазии может нарастать в ходе развития опухолей.
Наряду с морфологической анаплазией можно говорить о функциональной анаплазии – частичной или полной утрате опухолевой тканью способности выполнять специфические функции, характерные для соответствующей нормальной ткани: секреторные, сократительные и т.д
Биохимическая анаплазия проявляется в исчезновении из опухолевых клеток части, или всех специфических ферментов, характерных для исходных клеток. Так, в клетках анаплазированных гепатом не выявляются многие ферменты, специфические для нормальной печеночной клетки.
Наряду с исчезновением белков, характерных для ткани взрослого животного, в некоторых типах опухолей возобновляется синтез белков, специфичных для эмбриона. Наиболее ярким примером является возобновление синтеза эмбрионального альфа-фетопротеина клетками гепатом человека и животных.
Источник: boling.ru
В основе лечебного эффекта вакуума лежит его механическое воздействие на всю совокупность структур мягких тканей. Первоначальным результатом этого воздействия является весьма характерная реакция тканей, отражающая практически все признаки развития классического воспалительного процесса асептического типа. Особенно ярко она проявляется во время первых нескольких процедур ВГТ. Характерные признаки воспалительной реакции асептического типа включают в себя смешанную, или венозную, гиперемию, локальную отечность, повышение местной, а иногда и общей температуры тела, незначительные болевые ощущения, дискомфорт, элементы ограничения функции. Спустя 1-2 дня после процедуры явления дискомфорта, болезненности тканевых участков практически полностью исчезают. Как правило, такая реакция асептического воспаления возникает в основном на участках тканей с массивным венозно-интер-стициально-лимфатическим застоем. В то же время в здоровых тканях она отсутствует либо существенно сглажена.
ВГТ оказывает на организм флогогенное влияние. Его механическое воздействие на ткани не только вызывает увеличение локального кровотока и активацию NO-эргических систем эндотелия, но в первую очередь обусловливает первичную альтерацию структур мягких тканей. Возникающая альтерация запускает последовательный каскад типовых реакций васкуля-ризированных тканей в виде поэтапных изменений микроциркуляторного русла, реологических свойств крови, лимфы, интерстициальной жидкости и стро-мальных элементов, которые по своей сущности направлены на активацию регенерационно-репаративных процессов поврежденных тканей. Указанная реакция есть не что иное, как проявление асептического воспаления. В чем состоит сущность этой общебиологической реакции?
В общей патологии воспаление принято рассматривать как ключевой общепатологический и вместе с тем практически постоянно присутствующий в организме процесс (Серов, Пауков, 1995). Особенность воспаления как биологического процесса заключается в его защитно-приспособительной функции, которая состоит в сосудисто-мезенхимальной реакции, направленной на ликвидацию повреждающего агента и восстановление поврежденной ткани. Эта реакция носит циклический характер: гемо- и лимфососуди-стый ответ на альтерацию обеспечивает повышение сосудистой проницаемости как для плазмы, так и для клеток крови (экссудация). Это приводит к появлению клеточного воспалительного инфильтрата, служащего прежде всего активации фагоцитоза и вторичной деструкции тканей, их самоочищению, восстановлению и образованию новых клеточно-мезенхи-мальных элементов.
В течение всего процесса в очаге воспаления происходит смена клеточных коопераций, осуществляется трансформация клеток и сосудов, направленная на образование регенеративного пролифе-рата, которая завершается дифференциацией клеток и репарацией повреждений. Циклической воспалительной реакцией «руководят» рождающиеся в месте альтерации медиаторные плазменные и клеточные агенты воспаления. Они участвуют в регуляции сопряжения процессов альтерации, сосудистой реакции и фагоцитоза. Взаимодействие клеток воспалительного инфильтрата (макрофагов и лимфоцитов) запускает иммунную систему защиты организма. Система медиаторов последовательно включает не только главнейшие плазматические системы (кининовую, свертывающую и противосвертывающую, систему комплемента), но и активирует все клеточные элементы защиты (полиморфно-ядерные лейкоциты, моноциты, фибробласты) и синтез коллагена. Участие этих систем в воспалительной реакции филогенетически строго запрограммировано и жестко контролируется ме-диаторно-рецепторными связями.
Независимо от свойств повреждающего агента, при их огромном разнообразии, ответ тканей в основных чертах протекает однотипно, а его интенсивность определяется как масштабами и местом первичного повреждения, так и индивидуальными характеристиками реактивности тканей.
Общая картина событий классического воспаления представляется в виде следующей последовательности:
- Первичное повреждение (альтерация).
- Вторичное самоповреждение.
- Экссудация.
- Сосудистые реакции:
- артериальная гиперемия;
- смешанная гиперемия;
- венозная гиперемия;
- смешанный стаз;
- ишемия.
- Маргинация лейкоцитов.
- Эмиграция лейкоцитов.
- Внесосудистые реакции — хемотаксис, фагоцитоз.
- Сосудистые реакции:
- Пролиферация.
- Действие противоспалительных медиаторов (катехоламины, глюкокортикоиды, гепарин, антитрипсин, хондроитинсульфаты, арилсульфатаза).
- Активация фибробластов.
- Репарация.
Основные этапы асептического воспаления можно проследить на примере заживления ран первичным натяжением. Уже в первый день в очаге асептического воспаления отмечается формирование элементов новой ткани. К третьему дню происходит отчетливое новообразование капиллярной сети, достигающее своего максимума на пятые сутки. К четвертому дню наступает массовая пролиферация фибробластов. Богатая капиллярами и фибробластами грануляционная ткань полностью оформляется спустя 3-5 суток, причем из-за повышенной проницаемости пролиферирующего эндотелия формируются ее отек и обильный серозный экссудат. Волокна коллагена, синтез которого начинается на 3-5-е сутки, ориентируются поперечно и перекрывают дефект. Микроповреждение тканей стимулирует синтез и пролиферацию фибробластов и коллагена. Пролиферация фибробластов и коллагеногенез по времени занимают всю вторую неделю. Максимум синтеза коллагена наблюдается примерно через 14 суток. Его аккумуляция продолжается примерно до одного месяца, по другим данным, — более 100 дней; начиная с 35-х суток постепенно уменьшается скорость синтеза нуклеиновых кислот и коллагена, происходит инволюция грануляционной ткани.
В момент снятия швов (через 8-10 суток) рана не достигает еще и 15 % прочности интактной кожи, но спустя 30-35 дней, благодаря процессам неоваскуло-генеза и коллагеногенеза, ее прочность превышает 80 % от первоначальной величины для здоровой кожи. К концу месяца дефект закрыт интактным эпидермисом, под которым находится рыхлая соединительная ткань.
Необходимо подчеркнуть, что асептическое воспаление индуцирует явления новообразования не только кровеносных, но также и лимфатических капилляров.
Помимо регенерирующих клеток паренхимы (в каждом органе или ткани — своих) главными универсальными участниками воспаления практически повсюду в организме являются мезенхимальные элементы: эндотелиоциты, гладкомышечные клетки, тромбоциты, макрофаги, фибробласты и создаваемое ими межклеточное вещество.
Эндотелиоциты — плоские клетки, образующие вдоль базальных мембран сплошной слой, скрепляемый гликопротеидными и гликолипидными компонентами надмембранных систем и межклеточного пространства. В начале репарационной фазы воспаления происходят разрушение базальных мембран родительских сосудов и миграция клеток эндотелия по градиенту ангиогенных факторов. При этом эндотелиоциты образуют тяжи и выросты, направленные по градиенту факторов ангиогенеза. Позади переднего фронта мигрирующих эндотелиоцитов идет пролиферация клеток эндотелия. Просвет капилляра образуется путем слияния внеклеточных пространств соседних эндотелиоцитов. Для формирования внутренней поверхности капилляров достаточно трех клеток.
В ответ на повреждение микрососудов любого генеза возникают процессы регенерации, сопровождающиеся либо только воспалением поврежденных тканевых элементов, либо образованием новых сосудистых терминалей взамен выключенных из кровотока. Регенераторное новообразование сосудов связано с отпочковыванием от сохранившихся капилляров и посткапилляров (реже — от венул и еще реже — от прекапилляров) ростков зачатков эндотелия, которые затем по току крови устанавливают связь с другими или теми же микрососудами. Новообразующиеся капилляры анастомозируют только с функционирующими микрососудами (капиллярами, посткапиллярами, венулами) непосредственно либо путем стыковки с растущими навстречу сосудистыми зачатками. В дальнейшем одни новообразованные сосуды приобретают структуру истинных капилляров, а другие (в зависимости от их топографического расположения и особенностей местной гемодинамики) преобразуются в пре- или посткапилляры, а позже — в артериолы и артерии, венулы и вены. При регенераторном росте кровеносных сосудов эндотелий участвует в построении эндотелиалыюй выстилки и ее базальной мембраны. Все другие структуры их стенки строятся за счет трансформации периэндотелиально расположенных полипотентных клеток (перицитов) в фибробласты и гладкие миоциты.
Репаративная регенерация обычно завершается полным восстановлением конструкции соответствующих участков системы гемомикроциркуляции только при ограниченном повреждении микрососудистой сети. Полностью поврежденные сосудистые модули, как правило, не восстанавливаются.
Фибробласты — главные эффекторы репаративной стадии воспаления. Вместе с фиброцитами («фибробласты в покое») они представляют собой оседлые клетки соединительной ткани. Фибробласты чрезвычайно метаболически активны и специализированы на синтезе коллагена и эластина, коллаген-ассоциирован-ных белков и протеогликанов. В зоне репарации фибробласты, привлеченные факторами роста и хемоаттрак-тантами, появляются за 1-2 суток до формирования кровеносных капилляров и за 4-5 суток до образования коллагеновых волокон. Решающую роль в активации фибробластов играют макрофаги.
Гладкомышечные клетки представляют собой важный структурный элемент сосудистой стенки любых пекапиллярных сосудов. По своим метаболическим и пролиферативным свойствам эти клетки близки к фибробластам. Они располагают актиновыми и мнозино-выми фибриллярными элементами и индивидуальной для каждой клетки базальной мембраной.
При повреждении сосуда, если оно затрагивает ме-дию, гладкие миоциты переходят в синтетически-про-лиферативную стадию. Они утрачивают миозиновые фибриллы и сократимость, дедифференцируются, осуществляя хемотаксис в интиму, и проявляют необычайные пролиферативные свойства: на протяжении 48 часов после повреждения медии артерии в митоз вступают до 40 % их популяции. В этих условиях, подобно фибробластам, они вырабатывают волокнистые белки соединительной ткани и гликозаминогликаны.
Тромбоциты (кровяные пластинки) участвуют в процессах репарации как источники тромбоцитарных факторов роста, стимулирующих пролиферацию клеток сосудистой стенки. Например, тромбоцитарный фактор роста ингибирует коллагеназы, способствуя накоплению коллагена, а сократительные системы тромбоцитов вносят вклад в механическое стягивание краев раневых дефектов в процессе ретракции тромбов и кровяных сгустков.
При образовании новых сосудов большое значение имеют физические факторы: кровяное давление (повышение которого активирует синтез коллагена), парциальное давление кислорода, утрата взаимного контактного ингибирования эндотелиоцитов. Важнейшими факторами, стимулирующими ангиогенез, являются: факторы роста фибробластов (основной и кислый); сосудистый эндотелиальный фактор роста; трансформирующие факторы роста (а и Р); эпидермальный фактор роста.
Хемотаксис, активация и пролиферация фибробластов, стимуляция синтеза ими компонентов межклеточного матрикса и подавление активности ответственных за деградацию матрикса ферментов — металлопротеиназ — происходят под влиянием факторов роста фибробластов; тромбоцитарного фактора роста; трансформирующего фактора роста Р; фиброгенных цитоки-нов — кахексина и интерлейкина-1; кининов; тромбина.
Гладкомышечные клетки также отвечают пролифе-ративно-синтетической активацией на тромбоцитарный фактор роста, основной фактор роста фибробластов, интерлейкин-1, кахексии. Рост гладких миоцитов ингибируют гепарансульфат, окись азота, у-интерфе-рон, трансформирующий фактор роста р.
Наиболее активным и разносторонним медиатором фибро- и ангиогенеза признан трансформирующий фактор роста Р.
Рост и деление фибробластов начинаются после действия соответствующих факторов роста только в условиях связывания этих клеток с фибриллярными компонентами межклеточного матрикса через особый заякоривающий комплекс адгезивных белков и протео-гликанов. Решающую роль в активации фибробластов играют макрофаги, освобождающие фактор роста фибробластов под действием цитокинов.
Межклеточное вещество — это волокнистые белки (коллаген и эластин), погруженные в гель основного вещества, содержащий клейкие гликопротеиды и гли-козаминогликаны, а также воду и растворенные в ней соли кальция.
Вокруг эпителиальных и гладкомышечных и вдоль эндотелиальных клеток основное вещество формирует базальные мембраны. Подобные мембраны, сплетенные из нефибриллярного коллагена 4-го типа и колла-ген-ассоциированных белков, выполняют не только опорную функцию. Они представляют субстрат, с которым клетки комплементарно взаимодействуют. Эти взаимодействия контролируют миграцию, пролиферативно-синтетическую активность и полярность клеток, их адгезивные свойства. Если в ходе воспаления не нарушена или восстановлена целостность базальных мембран, на которых фиксируются паренхиматозные клетки, эндотелий, гладкомышечные элементы, то регенерация может привести к полному восстановлению нормальной структуры тканей.
Коллаген — важнейший молекулярный участник фиброплазии и самый распространенный белок животных клеток. Он присутствует ие только в колла-геновых волокнах и базальных мембранах, но и в аморфном основном веществе соединительной ткани. Выделяют около 19 типов коллагена, различающихся по свойствам и особенностям его функций в составе различных клеток и тканей. Метаболизм коллагена — неотъемлемая часть репарации при воспалении. Начальные этапы биосинтеза проколлагена протекают в рибосомах фибробластов и гладкомышечных клетках, а для некоторых типов коллагена — в эндотелии. Про-коллаген экскретируется в межклеточное пространство, где окисление лизиновых и гидроксилизиновых остатков ведет к образованию межмолекулярных связей, объединяющих а-цепи в волокна. Терминальные пептидазы отщепляют с-концевые пептиды от проколлагена, превращая его в коллаген.
Коллагеногенез в репаративной фазе воспаления стимулируется рядом сигнальных молекул: тромбоци-тарным фактором роста, фактором роста фибробластов, трансформирующим фактором роста Р, фиброгенными цитокинами (интерлейкинами 1-4) и кахексином. При репарации происходит перестройка соединительной ткани, требующая не только синтеза нового коллагена, но и усиления деградации остатков старого межклеточного вещества, что достигается путем стимуляции синтеза и экзоцитоза различных протеаз. Накопление коллагена в рубцовой ткани отражает преобладание синтеза коллагена над его элиминацией, что проявляется на фоне снижения уровня активаторов коллагеназ (например, плазмина, цитокинов) и увеличения действия их ингибиторов.
Коллаген-ассоциированные клейкие гликопротеи-ды и протеогликаны — это своеобразные молекулярные «переходники», связывающие, с одной стороны, компоненты межклеточного вещества, а с другой — интегральные компоненты клеточных мембран. Такие возможности делают их главными сборочными узлами «конструктора» стромы. К ним относят гликопротеи-ды фибронектин, ламинин, тромбоспондин, тенасцин, нидоген, а также протеогликан синдекан.
Механизмы репарации, включающие пролиферацию клеток, накопление компонентов межклеточного вещества, моделирование микроархитектуры ткани на основе самосборки путем межклеточных взаимодействий и взаимовлияний клеток с интерцеллюлярным матриксом, обеспечивают восстановление целостности тканей после повреждения.
Рассмотренные материалы убедительно свидетельствуют, что воспаление — уникальная реакция организма и уникальная категория общей патологии, значительно более широкая по сравнению с другими общепатологическими процессами. Как категория общей патологии воспаление имеет гомеостатический характер, в результате чего в самой альтерации тканей заложена их будущая репарация после отграничения и элиминации патогенного фактора. Вместе с тем, начавшись как местная реакция, воспаление включает интегрирующие и регулирующие системы всего организма, направленные на восстановление нарушенной функции и целостности поврежденной ткани. В результате организм часто приобретает новые свойства и качества, позволяющие ему значительно более эффективно взаимодействовать с окружающей средой.
Важнейшую составную часть проблемы морфологического восстановления (репарации) представляет собой обратимость процессов патологического повреждения тканей. Известно, что после того, как в ходе болезни наступает перелом в благоприятную сторону, «функциональное» выздоровление происходит быстрее «морфологического», т. е. клинические проявления исчезают намного раньше, чем происходят морфологические изменения в тканях и нормализуется их структура. Это объясняется тем, что восстановление функций обеспечивается на основе быстроразвер-тывающихся внутриклеточных регуляторно-репара-тивных процессов как в патологически измененных тканях, так и во всех функционально связанных с ними тканях и системах. Для обратимого развития склеротически и дистрофически измененных тканей требуется значительно больше времени. Поэтому «функциональное» выздоровление — бессимптомный постклинический период — предшествует полному «морфологическому» выздоровлению, что особенно важно учитывать в лечебно-профилактических мероприятиях.
Потенциальные возможности обратимости атрофии, белковой, жировой и других видов дистрофии тканей достаточно хорошо известны. Несомненно, это способствует оптимизации лечебно-профилактических мер при самых различных заболеваниях, в том числе тяжелых, вялотекущих. Однако, как известно, в теории и практике медицины термины «склероз», «дистрофия» прочно ассоциируются с понятием «необратимость». Между тем уже давно известны факты, противоречащие такой точке зрения. Так, еще в конце XIX в. И. П. Павлов и Г. А. Смирнов обратили внимание на возможность обратимости склероза тканей поджелудочной железы. Была также установлена возможность исчезновения со временем фиброзных изменений в скелетной мускулатуре. В печени даже далеко зашедшие структурные изменения могут подвергаться обратному развитию после устранения вызвавшей их причины. В клинической практике стимуляция процессов регенерации печеночной паренхимы приводила к ускорению обратимости цирроза печени у человека. Помимо этого принципиально важной является возможность обратимого развития не только избыточно разросшейся фиброзной ткани, но и других хронических структурных изменений, например гипертрофии органов и тканей. Многочисленные клинико-анатомические и клинические наблюдения свидетельствуют о том, что в результате нормализации нарушенной гемодинамики (устранение порока клапанов, аневризмы крупных периферических сосудов, гипертензии и т. д.) гипертрофия сердечной мышцы подвергается полному или почти полному обратному развитию с восстановлением исходной массы и размеров органа. В мышечных клетках при этом уменьшается число митохондрий, миофибрилл, рибосом, т. е. постепенно исчезают те структурные изменения, которые развились в качестве адаптационных в ходе патологического процесса или длительной гиперфункции и необходимость в которых отпала после ликвидации причины.
В основе реконструктивных механизмов обратимости дистрофических процессов тканей важную роль играют лизосомальные ферменты макрофагов, а также коллагенолитический фермент фибробластов.
Ряд специалистов уделяют большое внимание изучению иммунологических и молекулярных аспектов асептического воспаления и применяют полученные результаты в различных лечебно-профилактических целях, в том числе вызывая местное воспаление с помощью вакуумного воздействия. Так, в работе В. А. Чернавского показано, что механизмы лечебного действия вакуума связаны с асептическим повреждением ткани. В ответ на воздействие вакуума в тканях язвы развиваются биологические процессы, способствующие рассасыванию поврежденных клеточных элементов и белков крови.
Выделение гистамина, гиалуронидазы, адениловой кислоты обусловливает расширение сосудов, нормализует проницаемость сосудистой стенки и стимулирует фагоцитоз. Одновременно с этим повреждение капилляров, вызываемое вакуумом (петехии), обусловливает локальное кислородное голодание, которое, в свою очередь, стимулирует включение новых капилляров, своеобразно обновляя периферическое кровообращение. В возникающих при этом петехиях свернувшаяся кровь, подвергаясь аутолизу, оказывает стимулирующее действие, аналогичное механизму влияния аутогемотерапии.
В кардиологии применение трансмиокардиальной лазерной реваскуляризации с помощью высокоинтенсивного лазерного излучения (ВИЛИ) индуцировало в миокарде новообразование микрососудов за счет стимуляции эндотелия кровеносных сосудов, вызывало дегрануляцию и гиперплазию тучных клеток, что сопровождалось высвобождением в области транскар-диального лазерного канала биологически активных веществ, в том числе ростовых факторов. Стимуляция синтеза факторов роста в миокарде происходит за счет развития в ответ на воздействие ВИЛИ процесса асептического воспаления с последующей адаптивной регенерацией микрососудов.
Лечебное влияние процессов асептического воспаления, вызываемого путем применения метода локальных микронасечек в сочетании с ВГТ, при заболеваниях опорно-двигательной системы, язвенной болезни желудочно-кишечного тракта, нейроциркуляторной дистонии, ангиопатиях, вертебробазилярной недостаточности, косметических дефектах позволяет эффективно воздействовать на патологические процессы, способствуя усилению и ускорению репарации тканей с восстановлением их функций. Метод локальных микронасечек, являясь дополнительным инструментом в реконструктивном восстановлении поврежденных тканей, существенно ускорял сроки восстановительного лечения при различных заболеваниях.
Применяемые в косметологии процедуры ридоли-за и микротоковой терапии вызывают лифтинг кожи за счет стимуляции экссудации и инфильтрации тканей, т. е. возникновения процессов асептического воспаления. Это приводит к усилению размножения фибробластов и активации коллагенообразования.
Асептическое воспаление, возникающее в результате ВГТ, оказывает лечебное действие как на систему микроциркуляторного русла подвергнутых воздействию вакуума мягких тканей, так и на организм в целом, нормализуя его состояние за счет активации неспецифических систем адаптации.
Статьи по теме:
|
Репарация
в генетике, особая функция клеток, заключающаяся в способности исправлять химические повреждения и разрывы в молекулах дезоксирибонуклеиновой кислоты (См. Дезоксирибонуклеиновая кислота) (ДНК), возникающие вследствие воздействия различных физических и химических агентов, а также при нормальном биосинтезе ДНК в процессе жизнедеятельности клеток. Начало изучению Р. было положено работами А. Келнера (США), который в 1948 обнаружил явление фотореактивации (ФР) - уменьшение повреждения биологических объектов, вызываемого ультрафиолетовыми (УФ) лучами, при последующем воздействии ярким видимым светом (световая Р.). Р. Сетлоу, К. Руперт (США) и др. вскоре установили, что ФР - фотохимический процесс, протекающий с участием специального фермента и приводящий к расщеплению димеров Тимин а,
образовавшихся в ДНК при поглощении УФ-кванта. Позднее при изучении генетического контроля чувствительности бактерий к УФ-свету и ионизирующим излучениям была обнаружена темновая Р. - свойство клеток ликвидировать повреждения в ДНК без участия видимого света. Механизм темновой Р. облученных УФ-светом бактериальных клеток был предсказан А. П. Говард-Фландерсом и экспериментально подтвержден в 1964 Ф. Ханавальтом и Д. Петиджоном (США). Было показано, что у бактерий после облучения происходит вырезание поврежденных участков ДНК с измененными нуклеотидами и ресинтез ДНК в образовавшихся пробелах. Различают предрепликативную Р., которая завершается до начала репликации (См. Репликация)
хромосомы в поврежденной клетке, и пострепликативную Р., протекающую после завершения удвоения хромосомы и направленную на ликвидацию повреждений как в старых, так и в новых, дочерних молекулах ДНК. Считается, что у бактерий в пострепликативной Р.
важная роль принадлежит процессу генетической рекомбинации (См. Рекомбинация).
Системы Р. существуют не только у микроорганизмов, но также в клетках животных и человека, у которых они изучаются на культурах тканей. Известен наследственный недуг человека - пигментная ксеродерма, при котором нарушена Р. Каждая из систем Р. включает следующие компоненты: фермент, «узнающий» химически измененные участки в цепи ДНК и осуществляющий разрыв цепи вблизи от повреждения; фермент, удаляющий поврежденный участок; фермент (ДНК-полимераза), синтезирующий соответствующий участок цепи ДНК взамен удалённого; фермент (лигаза), замыкающий последнюю связь в полимерной цепи и тем самым восстанавливающий её непрерывность. У бактерий имеются по крайней мере 2 ферментные системы, ведущие Р. Первая осуществляет вырезание и ресинтез на небольшом участке в 5-7 нуклеотидов, вторая - на участке в тысячу нуклеотидов и более. Ферменты второй системы Р. участвуют также в процессах генетической рекомбинации. В случае повреждений, вызванных, например, УФ-светом, нормальная клетка кишечной палочки способна репарировать до 2000 повреждений; клетка с выведенной из строя первой системой Р. - около 100 повреждений; клетка с выведенными из строя обеими системами Р. погибает от одного повреждения. Существуют бактерии с исключительно активными ферментами Р. (например, Micrococcus radiodurans), которые благодаря этому способны выживать в воде, охлаждающей ядерные реакторы. Ферментные системы Р., как полагают, принимают участие и в нормальной репликации ДНК, т. е. её удвоении. При репликации материнская ДНК деспирализуется (раскручивается), что может сопровождаться разрывами её нитей. Кроме того, дочерние цепи ДНК синтезируются в виде небольших фрагментов. Поэтому заключительная фаза репликации - Р. всех дефектов, возникших при синтезе ДНК. Важная функция второй системы Р. - её участие в образовании мутаций (См. Мутации). Под действием различных мутагенов в ДНК образуются производные нуклеотидов, чуждые клетке. Они устраняются системой Р., которая заменяет их на нуклеотиды, естественные для ДНК, но иногда измененные по сравнению с первоначальными. Открытие Р. ДНК привело к коренным изменениям представлений о молекулярных механизмах, обеспечивающих стабильность генетического аппарата клеток и контролирующих темп мутационного процесса. С. Е. Бреслер.
Репарация в радиобиологии
, восстановление биологических объектов от повреждений, вызываемых ионизирующими излучениями. Р. осуществляется специальными ферментами и зависит от генетических особенностей и физиологического состояния облученных клеток и организмов. Изучение генетического контроля и молекулярных механизмов Р. клеток, поврежденных ультрафиолетовыми лучами и ионизирующими излучениями, привело к открытию Р. генетической (см. выше). У одноклеточных организмов и клеток растений и животных Р. приводит к повышению выживаемости, уменьшению количества хромосомных перестроек (См. Хромосомные перестройки) (аберраций) и генных мутаций. Р. способствуют: временная задержка первого после облучения деления клеток, некоторые условия их культивирования и фракционирование облучения. Так, при выдерживании дрожжевых клеток, облученных γ-лучами, α-частицами или нейтронами в лишённой питательных веществ среде, их жизнеспособность благодаря Р. возрастает в десятки и сотни раз, что соответствует уменьшению относительной биологической эффективности (См. Относительная биологическая эффективность) (ОБЭ) дозы в 4-5 раз (рис. 1
). Количество поврежденных хромосом у клеток облученных растений благодаря Р. может уменьшаться в 5-10 раз (рис. 2
). У многоклеточных организмов Р. проявляется в форме регенерации (См. Регенерация) поврежденных облучением органов и тканей за счет размножения клеток, сохранивших способность к делению. У млекопитающих и человека ведущая роль в Р. принадлежит стволовым клеткам (См. Стволовые клетки) костного мозга, лимфоидных органов и слизистой оболочки тонкого кишечника. При изучении Р. у млекопитающих обычно используют фракционированное облучение: благодаря Р. суммарный эффект двух доз тем меньше, чем больше интервал между ними. Р. можно стимулировать введением в организм после облучения небольшого количества необлучённых клеток костного мозга (подобный приём эффективен при лечении лучевой болезни (См. Лучевая болезнь)). Клетки и организмы с нарушенной Р. отличаются повышенной Радиочувствительность ю. Лит.:
Восстановление клеток от повреждений, пер. с англ., М., 1963; Корогодин В. И., Проблемы пострадиационного восстановления, М., 1966; Жестяников В. Д., Восстановление и радиорезистентность клетки, Л., 1968; Лучник Н. В., Биофизика цитогенетических поражений и генетический код, Л., 1968: Акоев И. Г., Проблемы постлучевого восстановления, М., 1970; Современные проблемы радиобиологии, т. 1 - Пострадиационная репарация, М., 1970; Восстановление и репаративные механизмы в радиобиологии, пер. с англ., М., 1972. В. И. Корогодин.
Рис. 1. Восстановление дрожжевых клеток от летальных повреждений, наблюдающееся при их выдерживании в среде, лишённой питательных веществ: 1 - зависимость выживаемости от дозы при высеве клеток на питательную среду сразу после облучения; 2 - то же при высеве через 48 ч
, в течение которых клетки находились в среде, лишённой питательных веществ; 3 - зависимость выживаемости клеток, облученных в дозе 70 крад
, от продолжительности выдерживания в среде, лишённой веществ. Стрелками показан способ расчёта питательных эффективной дозы. Ось абсцисс: вверху - доза γ-лучей (крад
), внизу - время восстановления (сутки): ось ординат - выживаемость (%).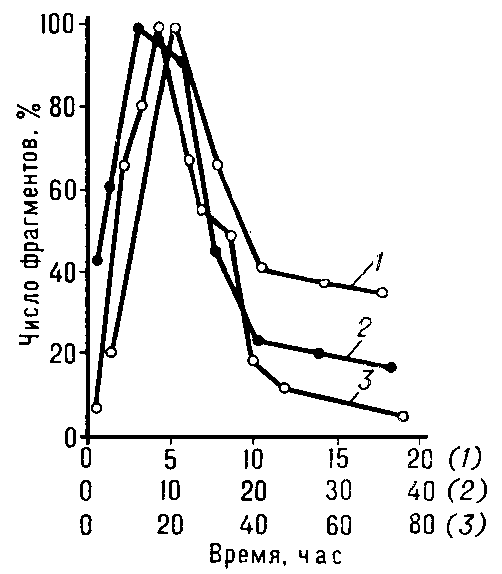
Большая советская энциклопедия. - М.: Советская энциклопедия . 1969-1978 .
Синонимы :Смотреть что такое "Репарация" в других словарях:
Возмещение, восстановление Словарь русских синонимов. репарация сущ., кол во синонимов: 2 возмещение (20) … Словарь синонимов
репарация - и, ж. reparation, > нем. Reparation < reparatio восстановление, обновление. 1. устар. Удовлетворение, сатисфакция. Но клевета на нас была явная, а оправдание без явной репарации может ли удовлетворить чести оскорбленных. 1788. А. Безбородко … Исторический словарь галлицизмов русского языка
Англ. reparations полное или частичное возмещение материального ущерба, причиненного войной. Словарь бизнес терминов. Академик.ру. 2001 … Словарь бизнес-терминов
РЕПАРАЦИЯ, свойственный клеткам всех организмов механизм исправления повреждений в молекуле ДНК, возникающих в ходе ее биосинтеза или под влиянием внешних химических или физических факторов (например, ионизирующих излучений); осуществляется… … Современная энциклопедия
Свойственный клеткам всех организмов процесс восстановления природной структуры ДНК, поврежденной при нормальном биосинтезе ДНК в клетке или в результате воздействия физическими или химическими агентами. Осуществляется специальными ферментными… … Большой Энциклопедический словарь
РЕПАРАЦИЯ, репарации, чаще мн., жен. (от лат. reparatio восстановление) (неол. полит.). Денежные и натуральные платежи, производимые побежденной страной победителю в возмещение убытков от войны. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
РЕПАРАЦИЯ, и, обычно мн., жен. (спец.). Возмещение за причинённые войной убытки, выплачиваемое стране победительнице тем побеждённым государством, к рое виновно в войне. | прил. репарационный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю.… … Толковый словарь Ожегова
- (от лат. reparatio восстановление), свойственный клеткам всех организмов процесс восстановления природной (нативной) структуры ДНК, повреждённой при нормальном биосинтезе ДНК в клетке, а также физич. или химич. агентами. Осуществляется спец.… … Биологический энциклопедический словарь
Репарация. См. репаративный синтез. (
ВВЕДЕНИЕ.
Целью данного реферата является сравнение двух процессов - процесса
злокачественного перерождения ткани и процесса репаративной регенерации. На
первый взгляд в них нет ничего общего, хотя наверняка это не так.
Мой реферат будет состоять из трех частей - в первой и второй частях я
опишу сущность процессов репарации и онкогенеза, влияющие на эти процессы
факторы, некоторые основные понятия связанные с этими явлениями. В
последней, третьей части я попытаюсь сравнить некоторые явления и процессы,
имеющие место быть в том или другом случае.
Начать следует с основных понятий:
«РЕГЕНЕРАЦИЯ (позднелатинское regeneratio –
возрождение, восстановление) – обновление структур организма в процессе
жизнедеятельности и восстановление структур, утраченных в результате
патологических процессов. Различают физиологическую и репаративную
регенерацию.
Физиологическая регенерация – непрерывное обновление структур на клеточном
(смена клеток крови, эпидермиса, печени и д.р.) и внутриклеточном
(обновление клеточных органелл) уровнях, благодаря чему обеспечивается
функционирование органов и тканей.
Репаративная регенерация – процесс ликвидации структурных повреждений после
действия патогенных факторов. В ее основе лежат такие же механизмы, как и
при физиологической регенерации, она отличается лишь большей интенсивностью
проявлений. Репаративную регенерацию, в процессе которой восстанавливается
ткань, идентичная погибшей, называется полной, или реституцией. В ряде
случаев в результате репаративной регенерации в зоне повреждения образуется
не специфическая для данного органа ткань, а рубец – неполная регенерация
или субституция. При некоторых состояниях организма (гиповитаминозе,
истощении и д.р.) течение репаративной регенерации бывает затяжным,
качественно извращенным (сопровождается образованием длительно незаживающих
язв, формирование ложного сустава и д.р.), то есть наблюдается
патологическая регенерация.
Процесс регенерации происходит на всех уровнях – органном, тканевом,
клеточном, внутриклеточном. Осуществляется он путем деления клеток,
обновления внутриклеточных структур и их размножения.
ОНКОГЕНЕЗ представляет собой длительный и многостадийный процесс,
состоящий из совокупности событий, которые в экспериментальных моделях
разделяют на стадии инициации, промоции и прогрессии. Хотя концепция
многостадийности онкогенеза была разработана исходя из результатов опытов с
использованием лабораторных животных, считается, что у человека опухолевый
процесс развивается подобным образом. Согласно существующим представлениям,
неопластическое перерождение ткани может происходить в результате
генетических изменений в одной клетке, которая в результате митотического
деления дает начало клону клеток, имеющих трансформированный фенотип. Эти
клетки претерпевают множественные изменения, прежде чем стать опухолевыми,
и каждая из стадий онкогенеза характеризуется определенными
фенотипическими, генотипическими и биохимическими особенностями.
РАКОВОЕ ПЕРЕРОЖДЕНИЕ.
ОНКОГЕНЫ, ПРОТООНКОГЕНЫ, АНТИОНКОГЕНЫ.
Во всех нормальных клетках есть гены, близкие по структуре к вирусным
онкогенам, они были названы протоонкогенами. Эти гены регулируют
нормальное поведение клетки – ее ответ на ростовые факторы, на гормоны,
нормальный темп и «расписание» делений. Протоонкогены находятся под
тщательным и жестким контролем других генов. Мутации протоонкогенов выводят
их из-под воздействия контролирующих генов, делают их автономными. Как
правило, воздействие различных канцерогенных факторов приводит к постоянной
активности протоонкогена. Так хромосомные транслокации ведут к тому, что
потоокоген попадает под контроль постоянно действующего в данной ткани
гена, и он работает непрерывно, не давая клетке выйти из цикла делений
(myc), или посылая непрерывные сигналы с мембраны в ядро(ras) , или приводя
к синтезу ростовых факторов, посылающих для той же клетки сигналы к делению
(аутокринная стимуляция). Канцерогенные вещества и облучение обладают
высокой мутагенной активностью, они вызывают изменения во многих генах, в
том числе и в протоонкогенах. Эти мутации могут вести либо к нарушению
регуляции протоонкогена, и тогда он выходит из-под контроля, либо к
изменению свойств белка, контролируемого этим геном. Мутировавшие онкогены
могут вызывать синтез онкобелка с измененными свойствами, и этот белок
вызывает уже те процессы, которые определяют характерное асоциальное
поведение клетки.
Итак, общим звеном в возникновении опухолей является онкоген,
внесенный в клетку вирусом, или возникший из протоонкогена, а результате
мутации, или выведенной из-под контроля сдерживающих генов хромосомной
транслокации. Но в последние годы найдено еще одно звено, по-видимому,
наиболее общее звЕно канцерогенеза – гены-супрессоры опухолей, подавляющие
активность онкогенов. Главный представитель антионкогенов - р53 ,
названный по продукту от р-protein, и 53 – тк вес 53000 дальтон.
Было показано, что накопление продуктов нормального гена р53
останавливает прохождение клеткой митотического цикла на границе G1 и S . в
результате поврежденная клетка не может удвоить поврежденную ДНК и передать
геном своим клеткам-потомкам при делении. У клетки есть спец ферменты,
ремонтирующие испорченную ДНК. Если через какое-то время повреждение
исправлено, то вызванный р53 блок деления снимается, и клетка может вновь
размножаться. Если повреждение ДНК не исправлено, тор53 включает программу
апоптоза.
БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
ОПУХОЛЕВЫХ КЛЕТОК.
Самой характерной биологической особенностью опухолевых клеток
является их автономность – независимость темпа размножения и других
проявлений их жизнедеятельности от внешних воздействий (по отношению к
клеткам), изменяющих и регулирующих жизнь нормальных клеток. Неправильно
опухоли - любое новообразование сохраняет ту или иную степень зависимости
от воздействующих на него факторов.
Также признаком многих, особенно злокачественных, опухолей я является
анаплазия ткани, возвращение ее к более примитивному типу.
Для морфологической анаплазии характерна утрата опухолевой тканью
особенностей, характерных для исходных дифференцированных тканей. Степень
анаплазии может нарастать в ходе развития опухолей.
Наряду с морфологической анаплазией можно говорить о функциональной
анаплазии – частичной или полной утрате опухолевой тканью способности
выполнять специфические функции, характерные для соответствующей нормальной
ткани: секреторные, сократительные и т.д..
Биохимическая анаплазия проявляется в исчезновении из опухолевых
клеток части, или всех специфических ферментов, характерных для исходных
клеток. Так, в клетках анаплазированных гепатом не выявляются многие
ферменты, специфические для нормальной печеночной клетки.
Наряду с исчезновением белков, характерных для ткани взрослого
животного, в некоторых типах опухолей возобновляется синтез белков,
специфичных для эмбриона. Наиболее ярким примером является возобновление
синтеза эмбрионального альфа-фетопротеина клетками гепатом человека и
животных.
Иммунологическая анаплазия проявляется в исчезновении из опухолевых
клеток ряда антигенов, типичных для нормальных клеток того же типа
(антигенное упрощение).
Инвазивный рост – способность опухолевой ткани врастать в окружающие
ткани и, разрушая, замещать их. Это – характерная черта злокачественности.
Метастазирование также принадлежит к числу наиболее характерных
отличительных особенностей злокачественных опухолей. Основными этапами
попадание их в кровеносный или лимфатический сосуд, циркуляцию этих клеток
в крои, или лимфе, прилипание клеток к сосудистой стенке и образование
опухолевого эмбола, выход клеток из сосуда и пролиферацию их с образованием
метастатического узла.
ОНКОГЕНЕЗ.
Инициация онкогенеза - это процесс, в ходе которого химические,
физические и биологические агенты изменяют определенные элементы генома
клетки-мишени. Для того чтобы изменения, произошедшие во время инициации
онкогенеза, закрепились, необходимо, чтобы осуществилась репликация ДНК
клетки. Мутации определенных генов могут изменить свойства клеток.
Изменения генома в первую очередь затрагивают гены, ответственные за
основные жизненно важные функции клеток. Для возникновения рака
недостаточно единичной мутации, а необходимы изменения в нескольких (не
менее двух) генах, один из которых обеспечивает иммортализацию (бессмертие)
клеток, а другой - развитие злокачественного фенотипа.
Промоция онкогенеза - это стадия, которая характеризуется увеличением
популяции инициированных клеток и дальнейшими изменениями в их геноме под
влиянием промоторов канцерогенеза, причем последние могут быть как
генотоксическими канцерогенами, так и эндогенными факторами (например,
стимуляция гормонами). Так формируется и увеличивается популяция клеток с
геномными повреждениями, предшествующими их злокачественному перерождению.
При этом возрастает вероятность вторичной мутации в какой-нибудь из клеток
в этой популяции, поскольку делящиеся клетки более чувствительны к действию
мутагенов. Главная особенность стадии промоции - ее обратимость и наличие
концентрационного порога в действии промоторов.
Прогрессия онкогенеза - это активная стадия опухолевого процесса,
когда пролиферация клона трансформированных клеток приводит к образованию
опухоли. Характерные признаки: усиление скорости роста клеток на фоне
снижения дифференцировочного потенциала этих клеток, проявление инвазивных
свойств и способности к метастазированию, нестабильность генома и
хромосомные абберации (изменение числа наборов хромосом или числа отдельных
хромосом, перестройки хромосом). Опухолевые клетки обладают преимуществами
перед нормальными клетками для роста и выживаемости в одинаковых условиях.
Для стадии прогрессии характерны глубинные нарушения уже между опухолью и
организмом.
В опухолевых клетках немного генов с измененной структурой. Все
опухолеспецифические гены проявляются по их измененной экспрессии,
приводящей в итоге к опухолевому фенотипу клеток.
Обнаружено, что в ответ на повреждение структуры ДНК и другие,
стрессовые для клетки воздействия быстро повышается продукция р53, что
может вызывать либо остановку клеточного цикла, либо апоптоз, а
неспособность белка гена р53 дикого типа транслоцироваться в ядро клетки
препятствует функционированию гена в качестве супрессора. Вероятно, именно
эта роль белка р53 в качестве "охранника генома" может обьяснить то
обстоятельство, что ген р53 наиболее часто изменен в опухолях человека.
Несмотря на многочисленные доказательства роли белка р53 в апоптозе,
выявлен ряд других генов, активация которых наблюдается во время р53-
опосредуемого апоптоза. Кроме того, непонятно каким образом проапоптическое
действие белка р53 может реализоваться независимо от транскрипционной
активности этого белка или почему в одних случаях р53 вызывает апоптоз,
тогда как в других происходит только остановка клеточного цикла.
Известно, что при прохождении клетки по циклу в нескольких критических
временных точках после проверки правильности реализации генетической
программы в ответ на действие как внутриклеточных, так и внеклеточных
стимулов клетка может либо завершить митоз, либо остановить клеточный цикл
для репарации повреждений, либо включить механизмы апоптоза. Процесс
клеточного деления происходит в результате циклической и регулируемой во
времени активации специфических ферментов, которые фосфорилируют (и таким
образом регулируют) белки, необходимые для прохождения митоза. Эти
ферменты, называемые циклинзависимыми киназами (CDK), активируются при
связывании с белковым кофактором - циклином, что способствует продвижению
клеток по фазам цикла, и ингибируются специфическими белками (CDK-
ингибиторами или CDI), что препятствует реализации клеточного цикла
Показано, что глюкокортикоидные гормоны, индуцирующие апоптоз, после
связывания с соответствующими специфическими рецепторами клеток-мишеней
действуют на уровне регуляции экспрессии генов, продукты которых
ответственны не только за пролиферацию, но и за апоптоз. Этими продуктами
являются с-Myc, циклин D3 и одна из его каталитических субъединиц - cdk 4,
а также белки рRb и E2F .
Теломераза - клеточный фермент, обеспечивающий восстановление длины
теломерного участка хромосомной ДНК, в большинстве клеток нормальных тканей
отсутствует. В клетках злокачественных опухолей ген теломеразы активен.
Однако, несмотря на то, что экспрессия теломеразы является одним из
характерных маркеров злокачественности клеток, сама по себе она не служит
причиной возникновения рака, поскольку клетки, трансформированные геном
теломеразы, сохраняют нормальный фенотип. Поэтому ингибиторы теломеразы
предполагается использовать для ограничения числа циклов деления опухолевых
Факторы роста
Факторы роста и контролируемые ими механизмы вызывают неудержимую
пролиферацию клеток, их подвижность, инвазивность, ангиогенез и фенотип.
ЭФР - эпидермальный фактор роста играет важную роль в регуляции
жизнедеятельности нормальных и опухолевых клеток. Вызывает устойчивость к
апоптозу.
РЭФР - это трансмембранный клеточный рецептор, синтез которого
кодируется геном с-erb B1. Установлено, что в ряде опухолей человека в
результате амплификации этого гена многократно возрастает синтез
вышеупомянутого рецепторного белка. РЭФР состоит из трех основных
функционально различных доменов: лигандсвязывающего, трансмембранного и
цитоплазматического, обладающего эндогенной протеинкиназной активностью и
катализирующего фосфорилирование белков плазматической мембраны, включая и
сам рецептор, и белков цитозоля, в основном по остаткам тирозина.
Последнему домену отводится важная роль в передаче регуляторного сигнала
внутри клеток-мишеней. При амплификации гена с-erb B1 клетка становится
более восприимчивой к воздействию ростовых факторов и реагирует на
ростстимулирующие субстанции, которые продуцируются интрацеллюлярно. Такой
механизм клеточной саморегуляции, известный как аутокринная петля
регуляторного роста, выводит процесс роста опухолевых клеток из-под влияния
контролирующих систем организма и многими исследователями он
рассматривается в качестве промотора канцерогенеза в солидных опухолях
человека различной локализации и гистогенеза. В одной клетке-мишени может
одновременно активироваться несколько аутокринных петель, гетерогенных по
составу лигандов и их рецепторов. ЭФР-подобные цитокины могут стимулировать
пролиферацию трансформированных клеток также с помощью паракринного
механизма, например, в случае их синтеза нормальными клетками,
соседствующими с опухолевым очагом. Учитывая то, что предшественники
цитокинов семейства ЭФР локализованы в плазматической мембране клеток,
следует иметь в виду и их способность стимулировать пролиферацию
сопредельных клеток по юкстакринному механизму, т.е. когда сигнальная
молекула фактора роста, обладая физиологической активностью еще находясь в
составе плазматической мембраны, может взаимодействовать с клеткой-мишенью.
Сосудистая патология является ключевой в прогрессии некоторых
опухолей, она характеризуется повышенной проницаемостью сосудов для
компонентов плазмы крови и гиперкоагуляцией. К цитокинам, обладающим
выраженным ангиогенным действием, относят ФРЭС, основной и кислый ФРФ,
инсулиноподобный фактор роста I, фактор роста гепатоцитов, ангиопоэтин,
плацентарный фактор роста (ПФР), связываемый гепарином ЭФР, ТФР-бета.
Инвазия. Изменения внеклеточного матрикса и базальной мембраны в
настоящее время рассматривается в качестве важнейших звеньев инвазии
опухолевых клеток. Инвазивный потенциал опухолевой клетки определяется ее
способностью активно мигрировать и вызывать частичную деградацию
соединительной ткани. Миграция клеток осуществляется за счет их
динамического взаимодействия друг с другом и с внеклеточным матриксом.
Трансмембранные белки интегрины связывают внеклеточный матрикс с
цитоскелетом путем образования специальных белковых комплексов. Лигандами
интегринов служат белки внеклеточного матрикса (ламинин, фибронектин), а
цитоплазматические участки интегринов соединены с актиновыми филаментами
цитоскелета с помощью таких белков, как талин, тензин, актинин-альфа. Таким
образом, интегрины опосредуют двунаправленную передачу регуляторных
сигналов из клетки в клетку. С цитоплазматическими доменами интегринов
может взаимодействовать протеинкиназа ILK(integrin-linked kinase),
активность, которой стимулируется после прикрепления клеток к внеклеточному
матриксу.
Другой класс трансмембранных белков, участвующих в образовании
контактов между цитоскелетными структурами клеток - кадгедрины. Они
связываются с микрофиламентами, микротрубочками и промежуточными
филаментами с помощью специальных адапторных белков. При снижении
экспрессии кадгедринов значительно ослабляется межклеточная адгезия и
адгезия к белкам внутриклеточного матрикса, что определяет способность
опухолевых клеток к инвазии.
Cпособность опухолевых клеток при инвазии в окружающие ткани вызывать
частичную деградацию соединительнотканных структур реализуется за счет
активности ряда протеиназ: цистеиновых, сериновых, аспарагиновых и
металлопротеиназ. Последние относятся к семейству, включающему следующие
эндопептидазы: коллагеназу, желатиназу и стромилизины. Активность протеиназ
регулируется специфическими эндогенными ингибиторами, например, тканевыми
ингибиторами металлопротеиназ (TIMP) или ингибиторами активатора
плазминогена (PAI). При инвазии и миграции опухолевых клеток отмечено
координированное действие интегринов не только с металлопротеиназами, но и
с активатором плазминогена урокиназного типа (URA), который является
сериновой протеиназой.
РЕПАРАТИВНАЯ РЕГЕНЕРАЦИЯ.
Репаративная регенерация включает в себя процессы распада поврежденных
клеток, дедифференцировки жизнеспособных клеток и их последующей
пролиферацией (при наличие столовых клеток способность пролиферировать
получают именно они), вторичную дифференцировку, установление межклеточных
связей (интеграцию).
При поранении и разрушении элементов ткани рядом с ними находится
повреждены, именно в этой зоне начнется пролиферация клеток в раневой
очаг. Разрушенная часть сразу же наполняется большим количеством
лейкоцитарных элементов – это воспаление.
В реактивной зоне начинается частичная деградация элементов ткани,
которые в норме являются высокоспецифичными клетками не способными к
делению. После дедифференцировки эти клетки начинают активно
пролиферировать, и все большее количество клеток высаживается в зону
поражения. Достаточную роль в этом процессе и его контроле играет
внеклеточный матрикс или ВКМ, а также matrix metalloproteinases или ММР. В
качестве примера этого влияния я приведу процесс заживления ран кожи.
Контроль во время ремодулирования ВКМ ведет к дифференцировки и
редифференцироке (а). В нормальном эпидермисе клетки расположены на
базальной мембране, которая отделяет их от подлежащей стромы(серая) ВКМ.(b)
Ранение: кератиноциты взаимодействуют с нативным коллагеном I и индуцируют
экспрессию ММР-1ю (с) Миграция: ММР-1 деградирует фибриллярный коллаген,
чтобы открыть скрытые сайты и индуцировать миграцию. (d) Локальная
деградация внутри, фибринового, сгустка вносит свой вклад в миграцию
кератиноцитов. (е) Синтез базальной мембраны супрессирует экспрессию. ММР-
1. (а) Даминин-5 (LM-5) ремодулирует с помощью плазмина индуцирует
образование гемидесмосом и стабилизирует эпителиальные взаимодействия с
базальной мембраной.
Базальные кератиноциты располагаются на базальной мембране. Вследствие
повреждения запускается цепь событий приводящих к миграции базальных
кератиноцитов, которые реэпителизируют рану. Одним из первых изменений
является нарушение кератиноцит-ВКМ взаимодействия на раневом крае, где
клетки, мигрирующие под базальную мембрану, подвергаются воздействию
дермальных коллагенов. В результате взаимодействия фибриллярного коллагена
с кератиноцитом?2?1 интегрин быстро запускает экспрессию ММР-1
(collagenase-1), которая затем взаимодействует с активированными
рецепторами epidermal growth factor (EGF). ММР-1 денатурирует фибриллярный
коллаген I, расщепляя? 1 и?2 цепи в специфических последовательностях
распознавания аминокислот, тем самым редуцирует их адгезивную функцию и
экспозирует сайты внутрь ВКМ для создания более благоприятной среды для
миграции. ММР-7 вовлекается в репарацию легких, но не ММР-1 и ММР-3
(stromelysin-1).
Ремоделирование ВКМ необходимо для проведения стоп-сигнала для миграции
кератиноцитов и запуска последующей ре-эпителизации. Базальная мембрана под
базальными кератиноцитами содержит ламинин-5б который обеспечивает
существенную структурную интеграцию с эпидермисом путем связывания
гемидесмосом в кератиноцитах с коллаген VII-содержащими якорными фибриллами
подлежащего дермиса. Ламинин-5 секретируемый подвижными трансформированными
клетками, содержит не подвергшуюся процессингу форму?3 субъединицы,
которая неспособна поддерживать сборку гемидесмосом, но пригодна для
миграции. Плазминоген связывается с этой субъединицей ламинина и после
активации с помощью tissue-type plasminogen activator (tPA) расщепляет
ламинин на более короткую форму, которая способствует сборке гемидесмосом и
теряет подвижность. Таким образом, ремоделирование ламинина может
превращать его из ВКМ белка, который управляет подвижностью, в адгезивную
форму, которая способствует дифференцировке. При заживлении ран плазминоген
необходим не только для конверсии ламинина, но также и для кератиноцитов,
проникающих в фибриновый сгусток, во время их миграторной фазы. Итак
продолжим. После фазы сверхактивной пролиферации наступает фаза вторичной
диффиренцировки, при которой происходит восстановление нормальной структуры
ткани. И последним этапом заживления можно назвать установление клеточных
контактов или интеграцию.
Вполне можно было бы ограничится такой схемой, но она применима для
однородной ткани, где все клетки - одой природы, но в организме гораздо
больше тканей, где одновременно существуют разной природы клетки. Таким
примером является печень, где наряду с гепатоцитами присутствую клетки
соединительно-тканной природы - фибробласты. При повреждении разных типов
клеток в одном органе, в норме при регенерации наш организм старается при
восстановлении выдержать их исходное соотношение. Однако, если на ту же
печень постоянно и часто оказывать какое-то повреждающее воздействие, то
преимущество будет у фибробластов, которые пролиферируют быстрее. В этом
случае печень зарастает соединительно-тканными рубцами и уже не может
выполнять свою функцию (цирроз печени).
Также при репарации наблюдается явление прорастания кровеносных
сосудов в регенерирующие ткани, в те места, где их в норме быть не должно.
Это необходимо для обеспечения прлиферирующих клеток кислородом и другими
необходимыми веществами.
Репаративная регенерация: 1- протекает локально, 2-начинается после гибели
большей, чем обычно массы ткани, 3-фазы «пролиферации» и
«дифференцировки» последовательны и коррелированы. Если дефект замещается
тканью идентичной ранее бывшей, то такой способ репаративной регенерации
относят к ПОЛНОЙ. Если зона дефекта замещается другой тканью (обычно
соединительной), то регенерацию называют НЕПОЛНОЙ. При этом возмещение
массы и структуры достигается через регенерационную гипертрофию.
Как известно, при научном изложении материала нельзя использовать один и
тот же термин при описаниях разнокачественных явлений. Термин
«пролиферация» исторически закрепился для обозначения одной из фаз
воспаления. Отсюда этот термин нельзя использовать при описании
регенерации. Именно поэтому в нашей лекции он взят в кавычки. Для фазы
регенерации нужно придумать другой термин. Среди частных примеров по
разделу репаративной регенерации клиницисту важнее всего разбираться в
заживлении ран. Всего описывается четыре способа заживления ран, но
наибольшую значимость имеют два: «путем первичного» и «путем вторичного
натяжения»
ФАКТОРЫ РОСТА.
ИНГИБИТОРЫ РОСТА.
Регенерация - это сложный процесс на который влияют множество
факторов стимулирующих и угнетающих пролиферацию, влияющих на рост,
дифференцировку и интеграцию. Ниже изложенные факторы действуют не только в
процессе репарации, но и в процессах эмбрионального гистогенеза, при росте
тканей в постнатальном развитии.
ЭПИДЕРМАЛЬНЫЙ ФАКТОР РОСТА – этот фактор я является одним из самых
активных митогенов среди известных полипептидных факторов роста. ЭФР с
молекулярной массой 6045 Да, состоит из 53 аминокислотных остатков. Он
может играть важную роль в индукции регенерации печени, осуществляя свое
регуляторное влияние вместе с другими полипептидными факторами роста, среди
которых в первую очередь следует назвать инсулин и гюкагон. ЭФР в
комбинации с инсулином и дексамиметазоном стимулирует пролиферацию
фибробластов, хондроцитов. На карциному А431 ЭФР влияет достаточно не
стандартно – здесь не трансформированный ЭФР является не катализатором, а
ингибитором пролиферации.
ФАКТОР РОСТА НЕРВОВ - молекулярная масса мономера - 13259 Да,
следует подчеркнуть, что он по первичной структуре близок к проинсулину.
ФАКТОР РОСТА ФИБРОБЛАСТОВ - молекулярная масс ФРФ 13400 Да. Он
стимулирует пролиферацию глиальных клеток, миобластов, хондроцитов, клеток
надпочечников. Ускорение митозов в клетках миобластов этим факторов
задерживает их дифференцировку, то же происходит и с хондроцитми.
Существуют также другие полипептидные факторы роста такие как, -
мезодермальный фактор роста, состоящий из группы полипептидов с
молекулярной массой около 2600 Да. Он стимулирует пролиферацию фибробластов
роговицы и играет важную роль в процессе регенерации роговицы. Фактор роста
кости имеет молекулярную массу 83000 Да, чувствителен к трипсину,
стимулирует пролиферацию клеток костей.
Наряду с полипептидными факторами роста описан целый ряд полипептидных
ингибиторов пролиферации клеток. Ингибиторы пролиферации клеток ранее чаще
именовали кейлонами. Эти вещества существенно различаются по молекулярной
термолабильности и иным свойствам. Кейлоны считаются ткане специфичными
регуляторами пролиферации, то есть образуются и проявляют свое ингибирующее
действие в одних и тех же тканях и не имеют выраженной видовой
специфичности. Предполагается, что каждый тип клеток образует свой
специфичный ингибитор пролиферации. Хотя для некоторых клеток известно
несколько таких веществ. Также ингибитором пролиферации клеток является
плотность их «населения». Для каждой ткани она специфична, и если при
регенерации происходит активное деления, то клетки делятся лишь до тех пор,
пока их количество будет в норме, после достижения оптимального количества
клеток пролиферация ингибируется.
Репарация ткани и
раковое перождение.
После того как более или менее детально разобраны процессы репарации и
онкогенеза можно перейти к их сравнению. Для сравнения этих двух процессов
я сначала скажу о некоторой общности опухолевых клеток и клеток
пролиферирующих в процессе репарации.
Для опухолевых клеток помимо описанных выше особенностей характерно
также наличие вариаций в соотношении объем ядра/объем клетки. В раковых
клетках постоянства этого соотношения не существует, так как интенсивно
делящиеся клетки опухоли просто не успевают «наращивать» нужный объем
цитоплазмы. Подобное явления наблюдается также и в процессе репарации
ткани, по той же самой причине.
Так же в процесс репарации наблюдается некоторая степень анаплазии,
поскольку чтобы клеткам с высокой степенью дифференцировки приобрести
способность к делению им просто, необходимо, дегенерировать
(дедиффиренцироваться), то есть для них характерна морфологическая
анаплазия. Так же пролиферирующие клетки не способны вырабатывать
специфичные ферменты, а значит в некоторой степени для них характерна
биохимическая анаплазия. Однако, в отличие от опухолевых клеток с течением
времени степень анаплазии не только не растет, а уменьшается и к окончанию
репарации анаплазия исчезает совсем.
Если сравнивать автономность, которая так характерна для опухолевых
клеток, то для колонии клеток, которая образуется в процессе репарации
автономность не характерна совсем. Этот клон целиком зависит от организма,
от индуцированных им факторов роста, от индуцированных им ингибиторов
пролиферации.
Также клон клеток, который образовался в процессе репарации крайне
нуждается в кислороде, для активного клеточного дыхания. Поэтому в область
поражения достаточно скоро прорастают капилляры. Для опухоли тоже
характерен такой процесс, однако, она сама «контролирует» количество
сосудов, которое ей необходимо. К тому же одной из особенностей опухолевых
клеток является то, что они в какой то мере способны к анаэробному дыханию,
что позволяет среднестатистической клетки опухоли находится дальше от
капилляра, по сравнению с любой не трансформированной клеткой.
Еще одно сходство заключается в том, что наиболее активированными как
в опухоли, так и в ране являются периферические клетки. Именно им присущи
наибольшая дедифференцировка и наибольшая пролиферативная активность.
Приведенные выше данные о сходстве роста клеток при регенерации
эпителия и при опухолевом росте хорошо известны. Но сущность их не
удавалось до сих пор удовлетворительно объяснить.
Можно отметить черты сходства в закономерностях установленных для
роста клеток при репаративной регенерации и новообразований. Прежде всего,
это относится к явлению активации. Сходство в том, что активация во всех
рассматриваемых случаях связана с увеличением свободной поверхности (в
случаях репаративной регенерации и новообразований это краевые клетки, не
связанные или слабо связанные с другими клетками). Чем меньше связаны
клетки организма, тем более выражена активация.
Так как основной причиной активирования клеток является увеличение их
свободной поверхности, то расположение клеток в организме не должно
допускать подобной возможности. Посмотрим внимательно и увидим, что вся
структурная организация нашего организма очень упорядочена, а клетки имеют
строго направленный рост, ведущий обязательно к уменьшению и к полному
исчезновению свободных, энергетически активных поверхностей. Так, клетки
всех органов и тканей между собой соединены, склеены, благодаря чему у них
нет свободных поверхностей. По мере нарастания прочности соединения клеток
тормозится их рост и увеличивается одновременно выраженность
дифференцировки. Округлая или овальная форма всех органов и организма в
целом обеспечивают замкнутую по кругу непрерывность соединений клеток между
собой без образования свободных поверхностей.
Кроме того, в организме имеются различные оболочки в виде фасций, мембран,
капсул и др. образований, которые укутывают группы клеток, органы, ткани и
тесно с ними склеены. Соприкасающиеся с внешней средой клетки также покрыты
или оболочками, или высыхающими, отторгающимися слоями клеток. Все это
обеспечивает не только строгую упорядоченность и стабильность структур
организма с отсутствием или минимальными уровнями свободной поверхности
клеток и, соответственно, низкой свободной энергией, но и является надежным
механизмом самоограничения и саморегуляции роста клеток.
В случае ранений, изъявлений или других дефектов тканей в процессе
репаративной регенерации по краю ран образуются зоны активированных клеток,
но сохраняющих связи между собой, так и строгую направленность роста. По
мере заполнения раневого дефекта и склеивания клеток с исчезновением у них
свободных краев, исчезает активация клеток и связанная с ней
дедифференцировка и восстанавливается непрерывность структуры ткани.
В тех случаях, когда поверхности в какой-то степени свободны или
полностью свободны, особенно когда клетки расположены неупорядоченно, они
становятся сильно активированными (возбужденными). И если при этом их рост
не может быть строго направленным, то он становится неограниченным,
опухолевым.
Имеются прямые доказательства, что клетки в раковых опухолях связаны между
собой значительно более рыхло, чем в соответствующих здоровых тканях.
Помимо способности к неограниченному росту, опухолевые клетки имеют еще
несколько способностей совершенно не свойственных репарирующим клеткам –
это способность к инвазии и метастазированию. Для злокачественных клеток и
то и другое крайне важно, с помощью этих приспособлений клетки опухоли
заселяют организм.
Некоторые ученые выделяют такой процесс, как гиперрегенерация,
которая в конечном итоге ведет к образованию опухоли.
Значительное преобладание новообразования ткани над ее гибель выражается в
период роста и развития в ПОРОКАХ РАЗВИТИЯ и УРОДСТВАХ (закономерности их
развития пока не известны). Гиперрегенерация как избыточное новообразование
ткани при возмещении потерь можно называть ГИПЕРПРОДУКЦИЕЙ. («дикое мясо»
в ранах, экзостозы вместо сращения перелома и др.)
В патологии часто встречаются ситуации, когда гибель ткани
малозаметна, а вот ее новообразование идет узлами. Возникновение таких
узлов начинается из особых «предельных состояний ткани – сфероидов». На
фазе «пролиферации» из «сфероидов» возникают радиально лучисто симметричные
системы конусовидных солидных масс клеток (рис 8), которые
дают начало своему сектору новообразования тканей. В ситуациях, когда
фаза «пролиферации» протекает очень быстро, возникают узлы резко
деформированных тканевых структур четко отграниченные от предсуществующих
тканей – т.н. «доброкачественные опухоли». В случаях когда «сфероид»
выходит за пределы регенерации начинается процесс особого дискретного
тканевого роста – «истинно опухолевый рост».
Основная часть вывода представлена в таблице1. Однако, хотелось бы
сказать, что наибольшее сходство между процессом репарации и
доброкачественной опухолью, где анаплазия выражена не столь сильно, а
метастазов и инвазии нет.
Возможно у репарации и за онкогенеза есть еще какие – то общие, еще
не известные нам черты. Возможно некоторые процессы протекают под влиянием
одних и сигналов, возможно в геноме репарирующих клеток включаются такие
же механизмы, что и в геноме опухолевых клеток, тогда когда они выходят из
нормального клеточного цикла и начинают активно пролиферировать. Это пока
еще не известно.
Репарация ткани |
Раковое перерождение.
|Воздействие. |Механическое повреждение ткани, вызывающее |Химическое воздействие или облучение, вирусы. |
| |гибель клеток. | |
|Реакция |Почти сразу, проявляется в воспалении |Латентный период в развитии опухоли обычно |
|организма. | |длится несколько лет. |
|Геном. | не поврежден. |В геноме есть несколько мутаций. |
|4. Пролиферация. |Контролируется организмом. |Деление не контролируемо. |
|5.анаплазия с |Снижается. |Растет. |
|течением процесса | | |
|6. инвазия |К инвазии не способны |Инвазия существует. |
|7. |Не способны |Существует. |
|Метастазирование | | |
Список литературы.
Б. Албертс и др. «Молекулярная биология клетки» Москва, Мир, 1994г.
Б.П. Ахмедов «Злокачественные новообразования» Москва, Медицина, 1984г.
«Биологические основы злокачественного рост» Сборник статей, Москва,
Иностранная литература,1950г.
И.Ф. Сейц, П.Г. Князев «Молекулярная онкология» Москва, Медицина, 1986г.
«Справочник онколога» Москва, Медицина, 1974г.
«Соросовский образовательный журнал»,Г.И. Абелев «Что такое опухоль»,
«Соросовский образовательный журнал»,В.Н. Сойфер «Репарация генетических
повреждений», 8/1997г.
«Соросовский образовательный журнал», Ю.М. Васильев « Социальное поведение
нормальных и а нтисоциальное поведение опухолевых клеток», 4,5/1997г.
«Украинский нейрохирургический журнал», «Онкогенез глиом головного мозга»,
Киев, 9/2000г.
Список литературы.
1. Б. Албертс и др. «Молекулярная биология клетки» Москва, Мир, 1994г.
2. Б.П. Ахмедов «Злокачественные новообразования» Москва, Медицина, 1984г.
3. «Биологические основы злокачественного рост» Сборник статей, Москва,
Иностранная литература,1950г.
4. И.Ф. Сейц, П.Г. Князев «Молекулярная онкология» Москва, Медицина, 1986г.
5. «Справочник онколога» Москва, Медицина, 1974г.
6. «Соросовский образовательный журнал»,Г.И. Абелев «Что такое опухоль»,
7. «Соросовский образовательный журнал»,В.Н. Сойфер «Репарация генетических
повреждений», 8/1997г.
8. «Соросовский образовательный журнал», Ю.М. Васильев « Социальное
поведение нормальных и а нтисоциальное поведение опухолевых клеток»,
9. «Украинский нейрохирургический журнал», «Онкогенез глиом головного
мозга», Киев, 9/2000г.
10. «Краткая медицинская энциклопедия». Москва. Издательство «Советская
энциклопедия». 1989 г
11. «Общая патология человека». Москва. Медицина.1990 г.
12. «врпросы репаративной и физиологической регенерации». Москва. Медиздат.
13. АА Климов. «Гистогенез и регенерация ткани». Ленинград. Медицина. 1984
14. АТ Бабаева.« Иммунологические механизмы регуляции восстановительных
процессов». Москва. Медицина. 1972 г.
15. СИ Кусень, РС Стойка. «Молекулярные механизмы в действии полипептидных
факторов роста». Москва. Наука. 1985 г.
Регенеранты и репарантыНормальная жизнедеятельность организма сопровождается непрерывным процессом замены отмирающих клеток и тканей, получившим название физиологической регенерации. Разные ткани отличаются по способности к восстановлению (регенерации), которая тем выше, чем большую роль играет физиологическая регенерация в структуре и функционировании ткани. Клетки крови, слизистых оболочек ЖКТ, покровного эпителия кожи и др. быстро обновляются и поэтому ткани, которые они формируют, характеризуются высоким потенциалом регенерации. Напротив, у нейронов и мышечных клеток потенциал регенерации минимален (приближается к нулевому). Под влиянием возраста, сопутствующих заболеваний, токсических и экологических факторов, радиации процесс физиологической регенерации может затормаживаться. Аналогичным эффектом обладают некоторые лекарственные средства, в т.ч. иммунодепрессанты, противоопухолевые препараты, кортикостероиды, некоторые антибиотики и НПВС и др. Угнетение процесса физиологической регенерации сопровождается развитием нарушений обменных процессов, возникновением лейко- и тромбоцитопении, анемии, поражением слизистых оболочек, в т.ч. ЖКТ и др. Лекарственные средства, способные увеличивать скорость и интенсивность физиологической регенерации получили название стимуляторов регенерации или регенерантов.
Восстановление участков тканей и органов, погибших в результате травм, повреждений или дистрофии (интоксикации, гипоксия, инфекции и др.) представляет собой процесс репаративной регенерации. Соответственно, препараты, обладающие способностью стимулировать регенерацию (репаративную регенерацию) - репарантами. В итоге репарации происходит замещение очагов некроза специфической и/или соединительной (имеет самый высокий потенциал регенерации) тканью.
Общий механизм регенеративного действия включает усиление биосинтеза пуриновых и пиримидиновых оснований, РНК, функциональных и ферментативных клеточных элементов, в т.ч. фосфолипидов мембран, а также стимуляцию редупликации ДНК и деления клеток. Следует заметить, что процесс биосинтеза в ходе как физиологической, так и репаративной регенерации нуждается в субстратном обеспечении (незаменимые амино- и жирные кислоты, микроэлементы, витамины). Кроме этого, процесс биосинтеза белков и фосфолипидов отличается высокой энергоемкостью и его стимуляция требует соответствующего энергообеспечения (энергетические материалы). К таким средствам, субстратно и энергетически обеспечивающим протекание процессов регенерации относятся Актовегин, Солкосерил и др. Эффект этих препаратов зачастую трудно отдифференцировать от собственно регенерирующего.
В соответствии с локализацией действия (и задачами фармакотерапии) стимуляторы регенерации и репарации условно подразделяются на общеклеточные (универсальные) и тканеспецифические. К общеклеточным стимуляторам, действующим на любую регенерирующую ткань, относятся анаболические стероиды (см. Анаболики), нестероидные анаболики - натрия дезоксирибонуклеат (Деринат), метилурацил, инозин и др. (см. Анаболики) и витамины пластического обмена (см. Витамины и витаминоподобные средства).
Тканеспецифические стимуляторы процесса регенерации представляют собой препараты с разным механизмом действия, объединенные в подгруппы по избирательному действию на ту или другую ткань или систему органов. Средства, восстанавливающие образование форменных элементов крови в костном мозге относятся к стимуляторам кроветворения (см. Стимуляторы гемопоэза).
Витамин D (см. Витамины и витаминоподобные средства) и препараты кальция, фосфора и фтора (см. Макро- и микроэлементы), хондроитин-сульфат (Структум), Остеогенон и др. обладают способностью усиливать регенеративные процессы в костной ткани (см. Корректоры метаболизма костной и хрящевой ткани). Восстановительные процессы в хрящевой ткани стимулируют и обеспечивают витамины C, E (см. Витамины и витаминоподобные средства), хондроитин-фосфат (см. Корректоры метаболизма костной и хрящевой ткани) и др. средства. Одной из самых представительных является группа препаратов - стимуляторов регенерации и репарации слизистой оболочки ЖКТ. Эти средства способствуют ускорению процесса заживления эрозивно-язвенных дефектов слизистой оболочки ЖКТ. Механизм репаративного действия препаратов этой группы, помимо стимуляции биосинтеза белка и клеточного деления, включает торможение свободно-радикальных реакций и либерации лизосомальных ферментов. Дополнительным фактором, играющим важную роль в проявлении репаративного эффекта, является усиление местного синтеза простагландинов, способных улучшать микроциркуляцию в слизистой оболочке ЖКТ.
К средствам, стимулирующим регенерацию и репарацию слизистой оболочки ЖКТ относятся висмута трикалия дицитрат (Де-нол), даларгин, натрия альгинат, Вентрамин, поливинокс и др. В гастроэнтерологической практике репаранты назначают после достижения ремиссии, при резистентности к обычным методам, в т.ч. в случае длительно нерубцующихся язв и чаще пациентам пожилого возраста.
Наибольшее число препаратов среди тканеспецифических стимуляторов регенерации оказывает влияние на регенерацию и репарацию кожных покровов. Показаниями к применению этих средств являются труднозаживающие раны, трофические язвы, ожоги, пролежни и др. У большинства средств данной группы, в т.ч. содержащих активные вещества из растений, способность стимулировать регенерацию кожи сочетается с другими эффектами: противовоспалительным (мазь окопника и календулы), антиоксидантным (Ревалид), восстановлением баланса свертывающей и противосвертывающей систем крови, улучшением локальной микроциркуляции и трофики кожи (Гепатромбин, ксимедона таблетки и др.) и антибактериальным (поливинокс, гиалуронат цинка, Фитостимулин и др.). Наличие антибактериального действия представляется наиболее значимым, учитывая повышенный риск инфицирования пораженных участков кожи. Основная цель назначения этих препаратов заключается в стимуляции регенерации дермальной и соединительной ткани в области поражения. Однако следует отметить, что заживление с эпителизацией кожных покровов возможно при поверхностных процессах (эрозиях, язвах, ожогах и др.). Более глубокие повреждения кожи заживают с формированием соединительно-тканного рубца.
Регенеративное действие в отношении нейронов оказывают ноотропы (см. Ноотропы (нейрометаболические стимуляторы)), Церебролизин (см. Ноотропы (нейрометаболические стимуляторы)), винпоцетин (см. Корректоры нарушений мозгового кровообращения) и др. Ретиналамин (комплекс полипептидных фракций из сетчатки глаз крупного рогатого скота или свиней) оказывает тканеспецифическое регенерирующее действие на сетчатку глаза.
