Плотное вещество кости функции. Строение костной ткани и кости как органа
Зубы располагаются в костных лунках - отдельных ячейках альвеолярных отростков верхней и нижней челюстей. Костная ткань - разновидность соединительной ткани, развивающаяся из мезодермы и состоящая из клеток, межклеточного неминерализованного органического матрикса (остеоид) и основного минерализованного межклеточного вещества.
5.1. ОРГАНИЗАЦИЯ И СТРОЕНИЕ КОСТНОЙ ТКАНИ АЛЬВЕОЛЯРНЫХ ОТРОСТКОВ
Поверхность кости альвеолярного отростка покрыта надкостницей (периост ), образованной преимущественно плотной волокнистой соединительной тканью, в которой различают 2 слоя: наружный - волокнистый и внутренний - остеогенный, содержащий остеобласты. Из остеогенного слоя надкостницы в кость проходят сосуды и нервы. Толстые пучки прободающих коллагеновых волокон связывают кость с надкостницей. Надкостница осуществляет не только трофическую функцию, но и участвует в росте и регенерации кости. Вследствие этого костная ткань альвеолярных отростков обладает высокой регенеративной способностью не только в физиологических условиях, при ортодонтических воздействиях, но и после повреждения (переломы).
Минерализованный матрикс организован в трабекулы - структурно-функциональные единицы губчатой костной ткани. В лакунах минерализованного матрикса и по поверхности трабекул располагаются клетки костной ткани - остеоциты, остеобласты, остеокласты.
В организме постоянно происходят процессы обновления костной ткани путём сопряженного по времени костеобразования и рассасы- вания (резорбция) кости. В этих процессах активно участвуют различные клетки костной ткани.
Клеточный состав костной ткани
Клетки занимают всего лишь 1-5% общего объёма костной ткани скелета взрослого человека. Различают 4 типа клеток костной ткани.
Мезенхимальные недифференцированные клетки кости находятся главным образом в составе внутреннего слоя надкостницы, покрывающей поверхность кости снаружи - периоста, а также в составе эндоста, выстилающего контуры всех внутренних полостей кости, внутренние поверхности кости. Их называют выстилающими , или контурными , клетками. Из этих клеток могут образовываться новые клетки кости - остеобласты и остеокласты. В соответствии с этой их функцией их также называют остеогенными клетками.
Остеобласты - клетки, находящиеся в зонах костеобразования на внешних и внутренних поверхностях кости. Остеобласты содержат достаточно большое количество гликогена и глюкозы. С возрастом это количество уменьшается в 2-3 раза. Синтез АТФ на 60% связан с реакциями гликолиза. По мере старения остеобластов реакции гликолиза активируются. В клетках протекают реакции цитратного цикла, и наибольшей активностью обладает цитратсинтаза. Синтезируемый цитрат используется в дальнейшем на связывание Ca 2+ , необходимого для процессов минерализации. Поскольку функцией остеобластов является создание органического межклеточного матрикса кости, эти клетки содержат большое количество РНК, необходимых для синтеза белков. Остеобласты активно синтезируют и выделяют во внеклеточное пространство значительное количество глицерофосфолипидов, которые способны связывать Ca 2+ и участвовать в процессах минерализации. Клетки сообщаются между собой через десмосомы, которые позволяют проходить Ca 2+ и цАМФ. Остеобласты синтезируют и выделяют в окружающую среду фибриллы коллагена, протеогликаны и гликозаминогликаны. Они также обеспечивают непрерывный рост кристаллов гидроксиапатитов и выступают в качестве посредников при связывании минеральных кристаллов с белковой матрицей. По мере старения остеобласты превращаются в остеоциты.
Остеоциты - древовидные клетки костной ткани, включенные в органический межклеточный матрикс, которые контактируют друг с другом через отростки. Остеоциты взаимодействуют и с другими клетками костной ткани: остеокластами и остеобластами, а также с мезенхимальными клетками кости.
Остеокласты - клетки, выполняющие функцию разрушения кости; образуются из макрофагов. Они осуществляют непрерывный управляемый процесс реконструкции и обновления костной ткани, обеспечивая необходимый рост и развитие скелета, структуру, прочность и упругость костей.
Межклеточное и основное вещество костной ткани
Межклеточное вещество представлено органическим межклеточным матриксом, построенным из коллагеновых волокон (90-95%) и основным минерализованным веществом (5-10%). Коллагеновые волокна в основном расположены параллельно направлению уровня наиболее вероятных механических нагрузок на кость и обеспечивают упругость и эластичность кости.
Основное вещество межклеточного матрикса состоит главным образом из внеклеточной жидкости, гликопротеинов и протеогликанов, участвующих в перемещении и распределении неорганических ионов. Минеральные вещества, размещённые в составе основного вещества в органическом матриксе кости представлены кристаллами, главным образом гидроксиапатитом Ca 10 (PO 4) 6 (OH) 2 . Соотношение кальций/фосфор в норме составляет 1,3-2,0. Кроме того, в кости обнаружены ионы Mg 2+ , Na + , K + , SO 4 2- , HCO 3- , гидроксильные и другие ионы, которые могут принимать участие в образовании кристаллов. Минерализация кости связана с особенностями гликопротеинов костной ткани и активностью остеобластов.
Основными белками внеклеточного матрикса костной ткани являются коллагеновые белки I типа, которые составляют около 90% органического матрикса кости. Наряду с коллагеном I типа присутствуют следы других типов коллагена, таких как V, XI, XII. Не исключено, что эти типы коллагена принадлежат другим тканям, которые и находятся в костной ткани, но не входят в состав костного матрикса. Например, коллаген V типа обычно обнаруживается в сосудах, которые пронизывают кость. Коллаген XI типа находится в хрящевой ткани и может соответствовать остаткам кальцифицированного хряща. Источником коллагена XII типа могут быть «заготовки» коллагеновых фибрилл. В костной ткани коллаген I типа содержит производные моносахаридов, имеет меньшее количество поперечных связей, чем в других видах соединительной ткани, и эти связи формируются посредством аллизина. Ещё одним возможным отличием является то, что N-концевой пропептид коллагена I типа фосфорилирован и этот пептид частично сохраняется в минерализованном матриксе.
В костной ткани содержится около 10% неколлагеновых белков. Они представлены гликопротеинами и протеогликанами (рис. 5.1).
Из общего количества неколлагеновых белков 10% приходится на долю протеогликанов. Вначале синтезируется большой хондроитин-
Рис. 5.1. Содержание неколлагеновых белков в межклеточном матриксе костной ткани [по Gehron R. P., 1992].
содержащий протеогликан, который по мере формирования костной ткани разрушается и замещается двумя малыми протеогликанами: декорином и бигликаном. Малые протеогликаны внедряются в мине- рализованный матрикс. Декорин и бигликан активируют процессы дифференцировки и пролиферации клеток, а также вовлечены в регуляцию отложения минералов, морфологию кристалла и объединение элементов органического матрикса. Первым синтезируется бигликан, содержащий дерматансульфат; он влияет на процессы клеточной пролиферации. В фазу минерализации появляется бигликан, связаный с хондроитинсульфатом. Декорин синтезируется позднее, чем бигликан, в стадию отложения белков для формирования межклеточного матрикса; он остаётся и в фазе минерализации. Предполагают, что декорин «отшлифовывает» молекулы коллагена и регулирует диаметр фибрилл. В ходе формирования кости оба белка продуцируются остеобластами, но когда эти клетки становятся остеоцитами, они синтезируют только бигликан.
Из костного матрикса в небольших количествах были выделены и другие типы малых протеогликанов, которые выступают в качестве
рецепторов и облегчают связывание факторов роста с клеткой. Эти типы молекул находятся в мембране или прикрепляются к клеточной мембране посредством фосфоинозитоловых связей.
В костной ткани также присутствует гиалуроновая кислота. Вероятно, она играет важную роль в морфогенезе этой ткани.
Помимо протеогликанов в кости определяется большое количество разнообразных белков, относящихся к гликопротеинам (табл. 5.1).
Как правило, эти белки синтезируются остеобластами и способны связывать фосфаты или кальций; таким образом они принимают участие в формировании минерализованного матрикса. Связываясь с клет- ками, коллагенами и протеогликанами, они обеспечивают образование надмолекулярных комплексов матрикса костной ткани (рис. 5.2).
В остеоиде присутствуют протеогликаны: фибромодулин, бигликан, декорин, коллагеновые белки и морфогенетический белок кости. В минерализованном матриксе замурованы остеоциты, которые связаны с коллагенами. На коллагенах фиксированы гидроксиапатиты, остеокальцин, остеоадерин. В минерализованном межклеточном

Рис. 5.2. Участие различных белков в образовании матрикса костной ткани.
Таблица 5.1
Неколлагеновые белки костной ткани
Белок | Свойства и функции |
Остеонектин | Гликофосфопротеин, способный связывать Са 2+ |
Отщепляет фосфат от органических соединений при щелочных значениях pH среды |
|
Тромбоспондин | Белок с мол. массой 145 кДа, состоящий из трех идентичных субъединиц, связанных друг с другом дисульфидными связями. Каждая субъединица имеет несколько различных доменов, которые придают белку способность связываться с другими белками костного матрикса - гепарансодержащими протеогликанами, фибронектином, ламинином, коллагеном I и V типов и остеонектином. В N-кон- цевой области тромбоспондина содержится последовательность аминокислот, обеспечивающая прикрепление клеток. На связывание тромбоспондина с рецепторами на поверхности клетки влияет кон- центрация Ca 2+ . В костной ткани тромбоспондин синтезируется остеобластами |
Фибронектин | Связывается с поверхностью клеток, фибрином, гепарином, бактериями, коллагеном. В костной ткани фибронектин синтезируется на ранних стадиях остеогенеза и сохраняется в минерализован- ном матриксе |
Остеопонтин | Гликофосфопротеин, содержащий N- и О-связанные олигосахариды; участвует в адгезии клеток |
Костный кислый гликопротеин-75 | Белок с мол. массой 75 кДа, содержит сиаловые кислоты и остатки фосфата. Способен связывать ионы Са 2+ , присущ кости, дентину и хрящевой ростковой пластинке. Ингибирует процессы резорбции костной ткани |
Костный сиалопротеин | Адгезивный гликопротеин, содержащий до 50% углеводов |
Матриксный Gla-белок | Белок, содержащий 5 остатков 7-карбоксиглутами- новой кислоты; способен связываться с гидроксиапатитом. Появляется на ранних стадиях развития костной ткани; белок обнаружен также в лёгких, сердце, почках, хряще |
матриксе остеоадерин связывается с остеонектином, а остеокальцин с коллагеном. Морфогенетический белок кости располагается в приграничной зоне между минерализованным и неминерализованным матриксом. Остеопонтин регулирует активность остеокластов.
Свойства и функции белков костной ткани представлены в табл. 5.1.
5.2. ФИЗИОЛОГИЧЕСКАЯ РЕГЕНЕРАЦИЯ КОСТНОЙ ТКАНИ
В процессе жизнедеятельности кость постоянно обновляется, то есть разрушается и восстанавливается. При этом в ней происходят два противоположно направленных процесса - резорбция и восстановление. Соотношение этих процессов называется ремоделированием костной ткани.
Известно, что каждые 30 лет костная ткань изменяется почти полностью. В норме кость «растет» до 20-летнего возраста, достигая пика костной массы. В этот период прирост костной массы составляет до 8% в год. Далее до 30-35-летнего возраста идет период более или менее устойчивого состояния. Затем начинается естественное постепенное снижение костной массы, составляющее обычно не более 0,3-0,5% в год. После наступления менопаузы у женщин отмечается максимальная скорость потери костной ткани, которая достигает 2-5% в год и продолжается в таком темпе до 60-70 лет. В итоге женщины теряют от 30 до 50% костной ткани. У мужчин эти потери обычно составляют 15-30%.
Процесс ремоделирования костной ткани происходит в несколько этапов (рис. 5.3). На первом этапе участок костной ткани, подле-
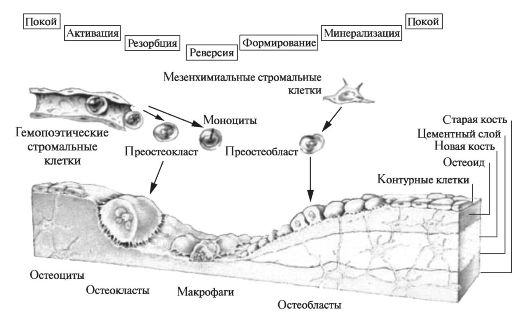
Рис. 5.3. Стадии ремоделирования костной ткани [по Martin R.B., 2000, с изменениями].
жащий резорбции запускают остеоциты. Для активации процесса необходимо участие паратиреоидного гормона, инсулиноподобного фактора роста, интерлейкинов-1 и -6, простагландинов, кальцитриола, фактора некроза опухоли. Тормозится этот этап ремоделирования эстрогенами. На данном этапе поверхностные контурные клетки изменяют свою форму, превращаясь при этом из плоских округлых клеток в кубические.
Остеобласты и Т-лимфоциты секретируют лиганды рецепторов активатора фактора нуклеации каппа В (RANKL) и до определённого момента молекулы RANKL могут оставаться связанными с поверхностью остеобластов или стромальных клеток.
Из стволовой клетки костного мозга образуются предшественники остеокластов. Они имеют мембранные рецепторы, называемые рецепторами активатора фактора нуклеации каппа В (RANK). На следующем этапе RANK-лиганды (RANKL) связываются с RANK- рецепторами, что сопровождается слиянием нескольких предшественников остеокластов в одну крупную структуру и формируются зрелые многоядерные остеокласты.
Образующийся активный остеокласт создаёт на своей поверхности гофрированный край и зрелые остеокласты начинают резорбировать
костную ткань (рис. 5.4). На стороне прилегания остеокласта к разрушаемой поверхности различают две зоны. Первая зона - наиболее обширная, называемая щеточной каемкой, или гофрированным краем. Гофрированный край - это скрученная спиралью мембрана с множественными цитоплазматическими складками, которые обращены в сторону резорбции на костной поверхности. Через мембрану остеокласта освобождаются лизосомы, содержащие большое количество гидролитических ферментов (катепсины К, D, B, кислая фосфатаза, эстераза, гликозидазы и др). В свою очередь, катепсин К активирует матриксную металлопротеиназу-9, которая участвует в деградации коллагена и протеогликанов межклеточного матрикса. В этот период в остеокластах растёт активность карбоангидразы. Ионы НСО 3 - обме- ниваются на Cl - , которые накапливаются в гофрированном крае; туда же переносятся ионы H + . Секреция H + осуществляется за счёт очень активной в остеокластах Н + /К + -АТФазы. Развивающийся ацидоз способствует активации лизосомных ферментов и способствует разруше- нию минерального компонента.
Вторая зона окружает первую и как бы герметизирует область действия гидролитических ферментов. Она свободна от органелл и назы-

Рис. 5.4. Активация преостеокласта RANKL и формирование активным остеобластом гофрированной каймы, приводящей к резорбции костной ткани [по Edwards P. A., 2005, с изменениями].
вается чистой зоной, поэтому костная резорбция происходит только под гофрированным краем в замкнутом пространстве.
На стадии образования остеокластов из предшественников процесс может блокироваться белком остеопротегерином, который, свободно перемещаясь, способен связывать RANKL и таким образом предотвращать взаимодействие RANKL с RANK-рецепторами (см. рис. 5.4). Остеопротегерин - гликопротеин с мол. массой 60-120 кДа, относящийся к семейству рецепторов ФНО. Ингибируя связывание RANK с RANK-лигандом, остеопротегерин тем самым подавляет мобилизацию, пролиферацию и активацию остеокластов, поэтому увеличение синтеза RANKL приводит к резорбции костной ткани и, следовательно, к потере костной массы.
Характер ремоделирования костной ткани во многом определяется балансом между продукцией RANKL и остеопротегерина. Недифференцированные стромальные клетки костного мозга в большей степени синтезируют RANKL и в меньшей степени остеопротегерин. Возникающий дисбаланс системы RANKL/остеопротегерин при увеличении RANKL приводит к резорбции кости. Данное явление наблюдается при постменопаузальном остеопорозе, болезни Педжета, костных потерях при метастазах рака и ревматоидном артрите.
Зрелые остеокласты начинают активно поглощать кость, а завершают разрушение органической матрицы межклеточного вещества кости макрофаги. Резорбция длится около двух недель. Затем остеокласты в соответствии с генетической программой умирают. Апоптоз остеокластов может задерживаться при недостатке эстрогенов. На последнем этапе в зону разрушения прибывают плюрипотентные стволовые клетки, которые дифференцируются в остеобласты. В дальнейшем остеобласты синтезируют и минерализуют матрикс в соответствии с новыми условиями статической и динамической нагрузки на кость.
Существует большое число факторов, стимулирующих развитие и функции остеобластов (рис. 5.5). Вовлечение в процесс перестройки кости остеобластов стимулируется различными факторами роста - ТФР-(3, морфогенетическим белком кости, инсулиноподобным фактором роста, фактором роста фибробластов, тромбоцитов, колониестимулирующим и гормонами - паратирином, кальцитриолом, а также связывающим фактором ядра α-1 и тормозится белком лептином. Лептин - белок с мол. массой 16 кДа образуется преимущественно в адипоцитах; своё действие реализует через повышение синтеза цитокинов, факторов роста эпителия и кератиноцитов.

Рис. 5.5. Ремоделирование костной ткани.
Активные секретирующие остеобласты создают слои остеоида - неминерализованного матрикса кости и медленно восполняют полость резорбции. При этом они секретируют не только различные факторы роста, а также белки межклеточного матрикса - остеопонтин, остеокальцин и другие. Когда образующийся остеоид достигает диаметра 6?10 -6 м, он начинает минерализоваться. Скорость процесса минерализации зависит от содержания кальция, фосфора и ряда микроэлементов. Процесс минерализации управляется остеобластами и тормозится пирофосфатом.
Образование кристаллов минерального остова кости индуцирует коллаген. Формирование минеральной кристаллической решётки начинается в зоне, находящейся между коллагеновыми фибриллами. Затем они, в свою очередь, становятся центрами для отложения в пространстве между коллагеновыми волокнами (рис. 5.6).
Формирование кости происходит только в непосредственной близости от остеобластов, причём минерализация начинается в хряще,

Рис. 5.6. Отложение кристаллов гидроксиапатита на коллагеновых волокнах.
который состоит из коллагена, находящегося в протеогликановом матриксе. Протеогликаны повышают растяжимость коллагеновой сети. В зоне кальцификации происходит разрушение комплексов белок-полисахарид в результате гидролиза белкового матрикса лизосомальными ферментами клеток кости. По мере роста кристаллы вытесняют не только протеогликаны, но и воду. Плотная, полностью минерализованная кость, практически обезвожена; коллаген составляет 20% массы и 40% объема такой ткани; остальное приходится на долю минеральной части.
Начало минерализации характеризуется усиленным поглощением остеобластами молекул O 2 , активацией окислительно-восстановительных процессов и окислительного фосфорилирования. В митохондриях накапливаются ионы Ca 2+ и PO 4 3- . Начинается синтез коллагеновых и неколлагеновых белков, которые затем после посттрансляционной модификации секретируются из клетки. Формируются различные везикулы, в составе которых переносится коллаген, протеогликаны и гликопротеины. От остеобластов отпочковываются особые образования, называемые матриксными пузырьками, или мембранными везикулами. Они содержат в большой концентрации ионы Ca 2+ , которая превышает в 25-50 раз содержание их в остеобластах, а также глицерофосфолипиды и ферменты - щелочную фосфатазу, пирофосфатазу,
аденозинтрифосфатазу и аденозинмонофосфатазу. Ионы Ca 2+ в мембранных везикулах связаны преимущественно с отрицательно заряженым фосфатидилсерином. В межклеточном матриксе мембранные везикулы разрушаются с освобождением ионов Ca 2+ , пирофосфатов, органических соединений, связанных с остатками фосфорной кислоты. Присутствующие в мембранных везикулах фосфогидролазы, и в первую очередь щелочная фосфатаза, отщепляют фосфат от органических соединений, а пирофосфат гидролизуется пирофосфатазой; ионы Ca 2+ соединяются с PO 4 3- , что приводит к появлению аморфного фосфата кальция.
Одновременно происходит частичное разрушение протеогликанов, связанных с коллагеном I типа. Освобождающиеся фрагменты протеогликанов, заряженные отрицательно, начинают связывать ионы Ca 2+ . Некоторое число ионов Ca 2+ и PO 4 3 образуют пары и триплеты, которые связываются с коллагеновыми и неколлагеновыми белками, формирующими матрицу, что сопровождается образованием кластеров, или ядер. Из белков костной ткани наиболее активно связывают ионы Ca 2+ и PO 4 3 остеонектин и матриксные Gla-белки. Коллаген костной ткани связывает ионы РО 4 3 через ε-аминогруппу лизина с образованием фосфоамидной связи.
На образовавшемся ядре возникают спиралевидые структуры, рост которых идет по обычному принципу добавления новых ионов. Шаг такой спирали равен высоте одной структурной единицы кристалла. Формирование одного кристалла приводит к появлению других кристаллов; этот процесс называется эпитаксисом, или эпитаксической нуклеацией.
Рост кристалла высоко чувствителен к присутствию других ионов и молекул, которые ингибируют кристаллизацию. Концентрация этих молекул может быть небольшой, и они оказывают влияние не только на скорость, но на форму и направление роста кристаллов. Предполагают, что такие соединения адсорбируются на поверхности кристалла и тормозят адсорбцию других ионов. Такими веществами являются, например, гексаметафосфат натрия, который тормозит преципитацию карбоната кальция. Пирофосфаты, полифосфаты и полифосфонаты также тормозят рост кристаллов гидроксиапатита.
Через несколько месяцев, после того как полость резорбции восполнится костной тканью, плотность новой кости увеличивается. Остеобласты начинают превращаться в контурные клетки, которые участвуют в непрерывном выведении кальция из кости. Некоторые
из остеобластов превращаются в остеоциты. Остеоциты остаются в кости; они связаны друг с другом длинными клеточными отростками и способны воспринимать механические воздействия на кость.
По мере дифференцировки и старения клеток меняется характер и интенсивность обменных процессов. С возрастом в 2-3 раза уменьшается количество гликогена; освобождающаяся глюкоза в молодых клетках на 60% используется в реакциях анаэробного гликолиза, а в старых на 85%. Синтезированные молекулы АТФ необходимы для жизнеобеспечения и минерализации костных клеток. В остеоцитах остаются лишь следы гликогена, и основным поставщиком молекул АТФ является только гликолиз, за счёт которого поддерживается постоянство органического и минерального состава в уже минерализованных отделах костной ткани.
5.3. РЕГУЛЯЦИЯ МЕТАБОЛИЗМА В КОСТНОЙ ТКАНИ
Ремоделирование костной ткани регулируется системными (гормоны) и местными факторами, которые обеспечивают взаимодейс- твие между остеобластами и остеокластами (табл. 5.2).
Системные факторы
Образование кости в известной степени зависит от числа и активности остеобластов. На процесс образования остеобластов влияют
Таблица 5.2
Факторы, регулирующие процессы ремоделирования кости

соматотропин (гормон роста), эстрогены, 24,25(ОН) 2 D 3 , которые стимулируют деление остеобластов и превращение преостеобластов в остеобласты. Глюкокортикоиды, напротив, подавляют деление остеобластов.
Паратирин (паратгормон) синтезируется в паращитовидных железах. Молекула паратирина состоит из одной полипептидной цепи, содержащей 84 аминокислотных остатков. Синтез паратирина стимулирует адреналин, поэтому в условиях острого и хронического стресса количество этого гормона увеличивается. Паратирины активирует пролиферацию клеток-предшественников остеобластов, продлевает время их полужизни и ингибирует апоптоз остеобластов. В костной ткани рецепторы для паратирина присутствуют в мембранах остеобластов и остеоцитов. Остеокласты лишены рецепторов для данного гормона. Гормон связывается с рецепторами остеобластов и активирует аденилатциклазу, что сопровождается увеличением количества 3" 5" цАМФ. Такое повышение содержания цАМФ способствует интенсивному поступлению ионов Ca 2+ из внеклеточной жидкости. Поступивший кальций образует комплекс с кальмодулином и далее происходит активация кальцийзависимой протеинкиназы с последующим фос- форилированием белков. Связываясь с остеобластами, паратирин вызывает синтез остеокласт-активирующего фактора - RANKL, способного связываться с преостеокластами.
Введение больших доз паратирина приводит к гибели остеобластов и остеоцитов, что сопровождается увеличением зоны резорбции, повышением уровня кальция и фосфатов в крови и моче с одновре- менным повышением экскреции гидроксипролина вследствие разрушения коллагеновых белков.
Рецепторы к паратирину располагаются и в почечных канальцах. В проксимальных отделах почечных канальцев гормон ингибирует реабсорбцию фосфата и стимулирует образование 1,25(ОН) 2 D 3 . В дистальных отделах почечных канальцев паратирин усиливает реабсорбцию Ca 2+ . Таким образом, паратирин обеспечивает повышение уровня кальция и снижение фосфатов в плазме крови.
Паротин - гликопротеин, выделяемый околоушными и поднижне- челюстными слюнными железами. Белок состоит из α-, β -, и γ-субъединиц. Активным началом паротина является γ-субъединица, которая оказывает влияние на мезенхимные ткани - хрящ, трубчатые кости, дентин зуба. Паротин усиливает пролиферацию хондрогенных клеток, стимулирует синтез нуклеиновых кислот и ДНК в одонтобластах, про-
цессы минерализации дентина и костей. Эти процессы сопровождаются понижением содержания кальция и глюкозы в плазме крови.
Кальцитонин - полипептид, состоящий из 32 аминокислотных остат- ков. Секретируется парафолликулярными К-клетками щитовидной железы или С-клетками паращитовидных желёз в виде высокомолекулярного белка-предшественника. Секреция кальцитонина возрастает при увеличении концентрации ионов Са 2+ и уменьшается при понижении концентрации ионов Са 2+ в крови. Она также зависит от уровня эстрогенов. При недостатке эстрогенов секреция кальцитонина снижается. Это вызывает усиление мобилизации кальция в костной ткани и способствует развитию остеопороза. Кальцитонин связывается с специфическими рецепторами остеокластов и клеток почечных канальцев, что сопровождается активацией аденилатциклазы и повышением образования цАМФ. Кальцитонин влияет на транспорт ионов Ca 2+ через клеточные мембраны. Он стимулирует поглощение ионов Ca 2+ митохондриями и тем самым задерживает отток ионов Ca 2+ из клетки. Этот зависит от количества АТФ и соотношения ионов Na + и K + в клетке. Кальцитонин угнетает распад коллагена, что проявляется уменьшением экскреции с мочой гидроксипролина. В клетках почечных канальцев кальцитонин ингибирует гидроксилирование 25(ОН)D 3 .
Таким образом, кальцитонин подавляет активность остеокластов и ингибирует освобождение ионов Ca 2+ из костной ткани, а также уменьшает реабсорбцию ионов Ca 2+ в почках. В результате тормозится резорбция костной ткани, стимулируются процессы минерализации, что проявляется понижением уровня кальция и фосфора в плазме крови.
Йодсодержащие гормоны щитовидной железы - тироксин (Т4) и трийодтиронин (Т3) обеспечивают оптимальный рост костной ткани. Тиреоидные гормоны способны стимулировать секрецию гормонов роста. Они повышают как синтез мРНК инсулиноподобного фактора роста 1 (ИФР-1), так и продукцию самого ИФР-1 в печени. При гипертиреозе подавляется дифференцировка остеогенных клеток и синтез белка в этих клетках, снижается активность щелочной фосфатазы. За счёт усиленной секреции остеокальцина активируется хемотаксис остеокластов, что ведёт к резорбции костной ткани.
Половые стероидные гормоны участвуют в процессах ремоделирования костной ткани. Воздействие эстрогенов на костную ткань проявляется в активации остеобластов (прямое и опосредованное действие), угнетении остеокластов. Они также способствуют всасыванию ионов Ca 2+ в желудочно-кишечном тракте и его отложению в костной ткани.
Женские половые гормоны стимулируют продукцию кальцитонина щитовидной железой и снижают чувствительность костной ткани к паратирину. Они также вытесняют на конкурентной основе кортикостероиды из их рецепторов в костной ткани. Андрогены, оказывая анаболическое действие на костную ткань, стимулируют биосинтез белка в остеобластах, а также ароматизируются в жировой ткани в эстрогены.
В условиях дефицита половых стероидов, который имеет место в менопаузе, процессы костной резорбции начинают преобладать над процессами ремоделирования костной ткани, что и приводит к раз- витию остеопении и остеопороза.
Глюкокортикоиды синтезируются в коре надпочечников. Основной глюкокортикоид человека - кортизол. Глюкокортикоиды скоординировано действуют на разные ткани и разные процессы - как анаболические, так и катаболические. В костной ткани кортизол тормозит синтез коллагена I типа, некоторых неколлагеновых белков, протеогликанов и остеопонтина. Глюкокортикоиды также уменьшают количество тучных клеток, являющихся местом образования гиа- луроновой кислоты. Под влиянием глюкокортикоидов ускоряется распад белков. Глюкокортикоиды подавляют всасывание ионов Ca 2+ в кишечнике, что сопровождается снижением его в сыворотке крови. Это понижение приводит к выбросу паратирина, который стимулирует образование остеокластов и резорбцию кости (рис. 5.7). Кроме того, кортизол в мышцах и костях стимулирует распад белков, что также нарушает формирование костной ткани. В конечном итоге действия глюкокортикоидов приводят к убыли костной ткани.
Витамин D 3 (холекальциферол) поступает с пищей, а также образуется из предшественника 7-дегидрохолестерола под влиянием ультрафиолетовых лучей. В печени холекальциферол превращается в 25(ОН)D 3 , а в почках происходит дальнейшее гидроксилирование 25(ОН)D 3 и образуются 2 гидроксилированных метаболита - 1,25(ОН) 2 D 3 и 24,25(ОН) 2 D 3 . Метаболиты витамина D 3 регулируют хондрогенез и остеогенез уже в процессе эмбрионального развития. В отсутствии витамина D 3 невозможна минерализация органического матрикса, при этом не образуется сосудистая сеть, а метафизарная кость не способна сформироваться должным образом. 1,25(ОН) 2 D 3 связывается с хондробластами, находящимся в активном состоянии, а 24,25(ОН) 2 D 3 - с клетками в состоянии покоя. 1,25(ОН) 2 D 3 регулирует зоны роста через образование комплекса с ядерным рецептором для этого витамина. Также показано, что 1,25(ОН) 2 D 3 способен связы-
Рис. 5.7. Схема влияния глюкокортикоидов на обменные процессы, приводящие к убыли костной ткани
ваться с мембранно-ядерным рецептором, что приводит к активации фосфолипазы С и образованию инозитол-3-фосфата. Кроме того, образующийся комплекс активируется фосфолипазой А 2 . Из осво- бождающейся арахидоновой кислоты синтезируется простагландин Е 2 , который также влияет на ответ хондробластов при их связывании с 1,25(ОН) 2 D 3 . Напротив, после связывания 24,25(ОН) 2 D 3 со своим мембранно-связывающимся рецептором, активируется фосфолипаза С, а затем протеинкиназа С.
В хрящевой зоне роста эпифизов костной ткани 24,25(ОН) 2 D 3 стимулирует дифференцировку и пролиферацию прехондробластов, которые содержат специфические рецепторы к данному метаболиту. Метаболиты витамина D 3 оказывают влияние на формирование и функциональное состояние височно-нижнечелюстного сустава.
Витамин А . При недостатке и избыточном поступлении витамина А в организм детей нарушается рост костей и происходит их деформация. Вероятно, эти явления обусловлены деполимеризацией и гидролизом хондроитинсульфата, входящего в состав хряща.

Витамин С . При недостатке аскорбиновой кислоты в мезенхемаль- ных клетках не происходит гидроксилирование остатков лизина и пролина, что приводит к нарушению образования зрелого коллагена. Образующийся незрелый коллаген не способен связывать ионы Ca 2+ и таким образом нарушаются процессы минерализации.
Витамин Е . При дефиците витамина Е в печени не образуется 25(ОН)D 3 - предшественник активных форм витамина D 3 . Дефицит витамина Е также может привести к снижению уровня магния в костной ткани.
Локальные факторы
Простагландины ускоряют выход ионов Ca 2+ из кости. Экзогенные простагландины увеличивают генерацию остеокластов, которые раз- рушают кость. Оказывают катаболическое воздействие на обмен белков в костной ткани и ингибирует их синтез.
Лактоферрин - железосодержащий гликопротеин, в физиологической концентрации стимулирует пролиферацию и дифференцировку остеобластов, а также ингибирует остеокластогенез. Митогенный эффект лактоферрина на остеобластоподобные клетки осуществляется через специфические рецепторы. Образовавшийся комплекс путём эндоцитоза поступает в клетку, и лактоферрин фосфорилирует митоген - активирующие протеинкиназы. Таким образом, лактоферрин выполняет роль фактора роста кости и её здоровья. Может применяться в качестве анаболического фактора при остеопорозе.
Цитокины - низкомолекулярные полипептиды, обусловливающие взаимодействие клеток иммунной системы. Они обеспечивают ответную реакцию на внедрение чужеродных тел, иммунное повреждение, а также воспаления, репарации и регенерации. Они представлены пятью большими группами белков, одной из которых являются интерлейкины.
Интерлейкины (ИЛ ) - белки (от ИЛ-1 до ИЛ-18), синтезируемые в основном Т-клетками лимфоцитов, а также мононуклеарными фагоцитами. Функции ИЛ связаны с активностью других физиологически активных пептидов и гормонов. В физиологической концентрации подавляют рост, дифференцировку и продолжительность жизни клеток. Cнижают продукцию коллагеназы, адгезию эндотелиальных клеток к нейтрофилам и эозинофилам, продукцию NO и, как следс- твие, наблюдается уменьшение деградации хрящевой ткани и резорбция кости.
Процесс резорбции костной ткани может активироваться при ацидозе и большими количествами интегринов, ИЛ и витамина A, но тормозится эстрогенами, кальцитонином, интерфероном и морфогенетическим белком кости.
Маркёры метаболизма костной ткани
Биохимические маркёры дают информацию о патогенезе заболеваний скелета и о фазах ремоделирования костной ткани. Различают биохимические маркёры формирования и резорбции кости, характе- ризующие функции остеобластов и остеокластов.
Прогностическая значимость определения маркёров метаболизма костной ткани:
Проведённый скрининг с использованием данных маркёров позволяет определить пациентов с высоким риском развития остеопороза; высокие уровни маркёров резорбции костей могут быть связаны с
увеличением риска переломов; повышение уровня маркёров метаболизма костной ткани у пациентов с остеопорозом более чем в 3 раза по сравнению с показателями нормы предполагает иную костную патологию, включая злокачественную; маркёры резорбции могут быть использованы в качестве дополнительных критериев при решении вопроса о назначении специальной терапии при лечении костной патологии. Маркёры резорбции кости . Во время обновления костной ткани коллаген I типа, который составляет более 90% органического матрикса кости и синтезируется непосредственно в костях, деградирует, а небольшие пептидные фрагменты попадают в кровь или выделяются почками. Продукции деградации коллагена можно определять как в моче, так и в сыворотке крови. Эти маркёры можно использовать при терапии препаратами, снижающими резорбцию костей, у пациентов с болезнями, связанными с нарушениями метаболизма костной ткани. В качестве критериев резорбции костной ткани выступают продукты деградации коллагена I типа: N- и С-телопептиды и тартрат-резистентная кислая фосфатаза. При первичном остеопорозе и болезни Педжета происходит отчетливое повышение С-концевого телопептида коллагена I типа и количество этого маркёра увеличивается в сыворотке крови в 2 раза.
Распад коллагена - единственный источник свободного гидроксипролина в организме. Преобладающая часть гидроксипролина
катаболизируется, а часть выделяется с мочой, главным образом, в составе небольших пептидов (ди- и трипептидов). Поэтому содержание гидроксипролина в крови и моче отражает баланс скорости катаболизма коллагена. У взрослого человека в сутки экскретируется 15-50 мг гидроксипролина, в молодом возрасте до 200 мг, а при некоторых болезнях, связанных с поражением коллагена, например: гиперпаратироидизме, болезни Педжета и наследственной гипергидроксипролинемии, причиной которой является дефект фермента гидроксипролиноксидазы, количество в крови и выделяемого с мочой гидроксипролина увеличивается.
Остекласты секретируют тартрат-резистентную кислую фосфатазу. При возрастании активности остеокластов происходит увеличение содержания тартрат-резистентной кислой фосфатазы и она попадает в повышенном количестве в кровоток. В плазме крови активность этого фермента возрастает при болезни Педжета, онкологических заболеваниях с метастазами в кость. Определение активности этого фермента особенно полезно при мониторинге лечения остеопороза и онкологических заболеваний, сопровождающихся поражением костной ткани.
Маркёры формирования кости . Формирование костной ткани оценивают по количеству остеокальцина, костного изофермента щелочной фосфатазы и остеопротегерина. Измерение количества сывороточного остеокальцина позволяет определять риск развития остеопороза у женщин, проводить мониторинг костного метаболизма во время менопаузы и гормональной заместительной терапии. Рахит у детей раннего возраста сопровождается снижением в крови содержания остеокальцина и степень снижения его концентрации зависит от выраженности рахитического процесса. У больных с гиперкортицизмом и пациентов, получающих преднизолон, значительно снижено содержание остеокальцина в крови, что отражает подавление процессов костеобразования.
Изофермент щелочной фосфатазы присутствует на клеточной поверхности остеобластов. При увеличенном синтезе фермента клетками костной ткани повышается его количество в плазме крови, поэтому определение активности щелочной фосфатазы, особенно костного изофермента, является информативным показателем костного ремоделирования.
Остеопротегерин выступает в качестве рецептора ФНО. Связываясь с преостеокластами, он ингибирует мобилизацию, пролиферацию и активацию остеокластов.
5.4. РЕАКЦИЯ КОСТНОЙ ТКАНИ НА ДЕНТАЛЬНЫЕ
ИМПЛАНТАТЫ
При различных формах адентии альтернативой съёмному протезированию являются внутрикостные дентальные имплантаты. Реакцию костной ткани на имплантат можно рассматривать как частный случай репаративной регенерации.
Различают три вида соединения дентальных имплантатов с костной тканью:
Прямое приживление - остеоинтеграция;
Фиброзно-оссальная интеграция, когда вокруг дентального имплантата образуется слой фиброзной ткани толщиной около 100 мкм;
Периодонтальное соединение (самый редкий вид), образующееся в случае периодонтального связочно-подобного сращения с периимплантационными коллагеновыми волокнами или (в некоторых случаях) цементирование внутрикостного дентального имплантата.
Считают, что в процессе остеоинтеграции после постановки дентальных имплантатов образуется тонкая зона из протеогликанов, которая лишена коллагена. Зона склеивания дентального имплантата с костью обеспечивается двойным слоем протеогликанов, включающим молекулы декорина.
При фиброзно-оссальной интеграции в соединении имплантата с костной тканью также участвуют многочисленные компоненты внеклеточного матрикса. За устойчивость имплантата в его капсуле отвечают коллагены I и III типа, а фибронектин играет основную роль в связывании элементов соединительной ткани с имплантатами.
Однако через какой-то период времени под действием механической нагрузки растёт активность коллагеназы, катепсина К и кислой фосфатазы. Это приводит к убыли костной ткани в периимплантационной области и происходит дезинтеграция дентального имплантата. Ранняя дезинтеграция внутрикостных дентальных имплантатов происходит на фоне сниженного количества в кости фибронектина, Gla-белка, тканевого ингибитора матриксных металлопротеиназ (ТИМП-1).
Скелет представляет основу, которая помогает телу держать форму, защищать органы, перемещаться в пространстве и многое другое. В общем, строение клеток костной, как и любой ткани, весьма специализированно, за счет чего есть прочность к механическому воздействию, а вместе с ней пластичность, параллельно с этим происходят процессы регенерации. К тому же клетки находятся в строго определенном взаиморасположении, благодаря чему костная, а не другая ткань, намного прочнее соединительной. Основными составляющими костной ткани являются остеобласты, остеокласты, а также остеоциты.
Именно эти клетки поддерживают свойства ткани, обеспечивая ее гистологическое строение. Какой же секрет этих трех клеток, которые имеет в своем составе кость, определяя многие функции. Ведь прочнее кости только зубы, которые содержат в себе альвеолы челюсти. Через кости проходят сосуды, нервы, как в черепе, они содержат в себе мозг, являющийся источником кроветворения, и защищают внутренние органы. Покрытые сверху хрящевой прослойкой, они обеспечивают нормальное передвижение.
Остеобласт, что он собой представляет
Строение этой клетки специфическое, она представляет собой видимое под микроскопом овальное или кубическое образование. Лабораторная техника показала, что внутри цитоплазмы ядро у остеобласта крупное, светлого цвета, расположено не центрально, а несколько в сторону периферии. Рядом есть парочка ядрышек, это свидетельствует о том, что клетка способна синтезировать многие вещества. Также она имеет много рибосом, органелл, за счет которых и происходит синтез веществ. Также в этом процессе участвует гранулярная эндоплазматическая сеть, комплекс Гольджи, который выводит продукты синтеза наружу.
За то, какое будет энергетическое обеспечение, отвечают многочисленные митохондрии. На них лежит большая работа, много их содержится в мышечной ткани. А вот в хрящевой, грубоволокнистой соединительной ткани, в отличие от мышечной, митохондрий намного меньше.
Функции клетки
Основная работа клетки состоит в том, чтобы производить межклеточное вещество. Также они обеспечивают минерализацию костной ткани, за счет этого она имеет особую прочность. Дополнительно клетки участвуют в синтезе многих важных ферментов костной ткани, основным из которых является щелочная фосфатаза, коллагеновые особой прочности волокна и многое другое. Ферменты, покидая пределы клетки, обеспечивают минерализацию кости.
Разновидности остеобластов
Помимо того, что строение клеток специфично, они функционально активны в различной степени. Активные имеют высокую синтетическую способность, а вот неактивные находятся в периферической части кости. Последние расположены возле канала кости, являются частью надкостницы, оболочки, покрывающей кость. Строение их сводится к небольшому количеству органелл.
Остеоцит, его строение
Эта клетка костной ткани является более дифференцированной, чем предыдущая. Есть у остеоцита отростки, которые находятся в канальцах, проходящих сквозь минерализованный матрикс кости, направление их различное. Плоское тело расположено в углублении – лакунах, со всех сторон окружено минерализованной составляющей. В цитоплазме имеется ядро овальной формы, занимающее практически весь ее объем.
Слабое развитие имеют органеллы, небольшое количество рибосом, каналы эндоплазматической сети короткие, митохондрии, в отличие от мышечной, хрящевой ткани, немногочисленны. Через каналы, имеющие лакуны, клетки могут взаимодействовать друг с другом. Микроскопическое пространство вокруг клетки имеет скудное количество тканевой жидкости. В ней есть ионы кальция, остатка, фосфора, коллагеновые волокна (минерализированные или нет).
Функция
Задача клетки состоит в том, чтобы регулировать целостность костной ткани, участвовать в минерализации. Также функции клетки состоят в том, чтобы отвечать на возникающую нагрузку. 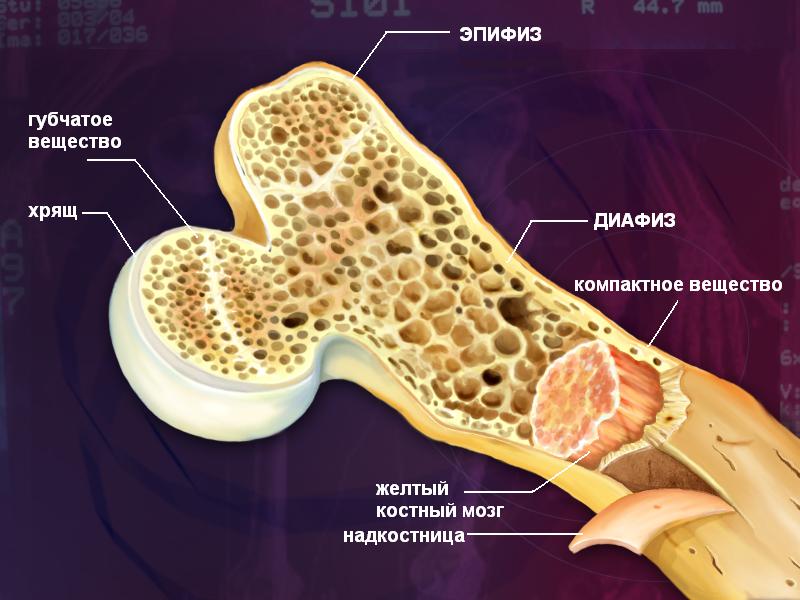 В последнее время все более популярным становится тот факт, что клетки участвуют в процессах метаболизма костной ткани, в том числе и челюсти. Есть предположение о том, что работа клетки состоит дополнительно в том, чтобы регулировать ионный баланс организма.
В последнее время все более популярным становится тот факт, что клетки участвуют в процессах метаболизма костной ткани, в том числе и челюсти. Есть предположение о том, что работа клетки состоит дополнительно в том, чтобы регулировать ионный баланс организма.
Во многом функции остеоцитов зависят от стадии цикла жизни, как хрящевой, мышечной ткани, а также воздействия гормонов на них.
Остеокласт, его секрет
Эти клетки значительных размеров, содержат много ядер, по своей сути, это производные кровяных моноцитов. По периферии клетка имеет гофрированную щеточную каемку. В цитоплазме клетки есть много рибосом, митохондрий, развиты канальцы эндоплазматической сети, а также комплекс Гольджи. Также клетка содержит большое число лизосом, фагоцитирующих органелл, всевозможных вакуолей, пузырьков.
Задачи
Эта клетка имеет свои задачи, она может создавать вокруг себя кислую среду в результате биохимических реакций в ткани кости. В результате растворяются минеральные соли, после чего ферментами и лизосомами старые или отмершие клетки растворяются и перевариваются.
Таким образом, работа клетки состоит в том, чтобы постепенно разрушать устаревшую ткань, но при этом обновляется строение костной ткани. В результате на ее месте появляется новая, за счет чего обновляется костная структура.
Другие компоненты
Несмотря на свою прочность (как у бедра или нижней челюсти), в кости присутствуют органические вещества, которые дополняются неорганическими. Органическая составляющая представлена на 95% коллагеновыми белками, остальное количество занимают неколлагеновые, а также гликозминогликаны, протеогликаны.
Неорганическая составляющая костной ткани представляет собой кристаллы вещества, называемого гидроксиапатитом, содержащем в большом количестве ионы кальция, а также фосфора. Меньше в пластинчатой структуре кости содержится солей магния, калия, фторидов, бикарбонатов. Постоянно происходит обновление пластинчатой структуры, межклеточного вещества вокруг клетки.
Разновидности
Всего костная ткань имеет два типа, все зависит от микроскопического ее строения. Первая называется ретикулофиброзной или грубоволокнистой, вторая - пластинчатой. Рассмотрим каждую в отдельности.
У эмбриона, новорожденного
Ретикулофиброзная широко представлена у эмбриона, ребенка после появления на свет. У взрослого же человека много соединительной ткани, а эта разновидность встречается только в месте, где сухожилие прикреплено к кости, в месте соединения швов на черепе, в линии перелома. Постепенно ретикулофиброзная ткань заменяется пластинчатой.
Имеет эта костная ткань особое строение, ее клетки расположены неупорядоченно в межклеточном веществе. Коллагеновые волокна, являющиеся разновидностью соединительной ткани, мощные, плохо минерализованы, направление имеют различное. Ретикулофиброзная кость имеет большую плотность, но клетки не имеют ориентации по соединительной ткани коллагеновых волокон.
У взрослого
Когда младенец вырос, его кость содержит в основном пластинчатую костную ткань. Эта разновидность интересна тем, что минерализованным межклеточным веществом образованы костные пластинки, имеющие толщину от 5 до 7 мкм. Любая пластина состоит из коллагеновых волокон соединительной ткани, расположенных параллельно, максимально близко, а также пропитанных кристаллами специального минерала – гидроксиаппатита.
В соседних пластинах волокна соединительной ткани проходят под разным углом, это обеспечивает прочность, к примеру в бедре или челюсти. Лакуны или альвеолы между пластинами в упорядоченном порядке содержат клетки кости – остеоциты. Их отростки по канальцам проникают в рядом расположенные пластины, за счет чего образуются межклеточные контакты соседних клеток.
Есть некоторые системы пластинок:
- окружающие (наружные или расположенные изнутри);
- концентрические (входящие в структуру остеона);
- вставочные (остаток разрушающегося остеона).
Строение кортикального, губчатого слоя
В основе этого слоя находятся минеральные соли, в челюсти именно сюда через альвеолы вживляются импланты. Базальный слой расположен наиболее глубоко, является наиболее прочным, есть в челюсти много перегородок, пронизанных капиллярами, их же немного.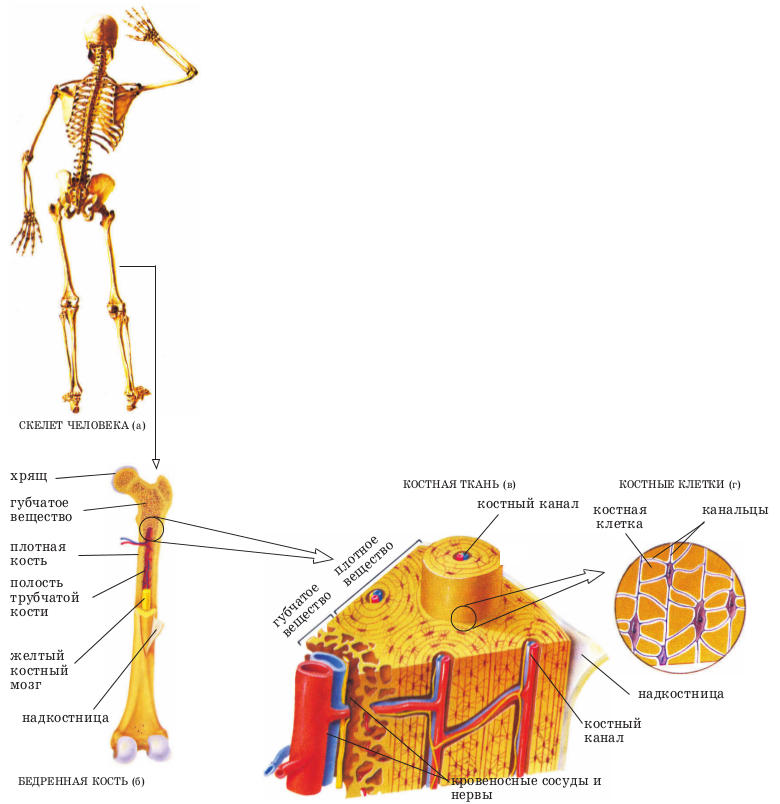
В центральном отделе находится губчатое вещество, в его строении есть некоторые тонкости. Построено оно из перегородок, капилляров. За счет перегородок кость имеет плотность, а по капиллярам она получает кровь. Их функции в челюсти заключаются в питании зубов, насыщении кислородом.
В костях организма, в том числе челюсти, которая содержит альвеолы, есть компактное, а потом следующее за ним губчатое вещество. Обе эти составляющие имеют несколько разное строение, но образованы тканью пластинчатого типа. Компактное вещество расположено снаружи, к нему идет прикрепление мышечной, хрящевой или соединительной ткани. Его функции сводятся к тому, чтобы придать кости плотность, как, к примеру, на челюсти, альвеолы которой несут нагрузку от пережевывания пищи.
Губчатое вещество расположено внутри любой кости, в том числе челюсти, в нижней части его содержат альвеолы. Его функции сводятся к дополнительному укреплению кости, в придании ей пластичности, эта часть является вместилищем костного мозга, который продуцирует клетки крови.
Немного фактов
Всего у человека содержится от 208 до 214 костей, которые состоят наполовину из неорганической составляющей, четверть приходится на органические вещества, а еще четверть - на воду. Все это связано между собой соединительной тканью, коллагеновыми волокнами и протеогликанами.
В составе кости есть органическая составляющая, как в мышечной, соединительной или хрящевой ткани, всего от 20 до 40%. Доля неорганических минералов занимает от 50 до 70%, клеточные элементы содержатся от 5 до 10%, а жиры – 3%.
Вес скелета человека составляет в среднем 5 кг, много зависит от возраста, половой принадлежности, количества соединительной ткани, строения тела и показателей роста. Количество кортикальной кости составляет в среднем 4 кг, это составляет 80%. Губчатое вещество трубчатых костей, челюсти и других весит где-то килограмм, что составляет 20%. Объем скелета равняется 1,4 литра.
Кость в скелете человека представляет собой отдельный орган, который может иметь свои определенные проблемы. Именно в костях часто всего случаются травмы, которые в зависимости от типа имеют различные сроки заживления. Если смотреть на кость невооруженным взглядом, то становится понятно, что каждая из них отличается по своей форме. Это связано с тем, какие функции она выполняет, какая нагрузка на нее воздействует, сколько мышц прикрепляется.
Кости позволяют человеку перемещаться в пространстве, они являются защитой для внутренних органов. И чем более важен орган, тем сильнее он окружен костями. С возрастом способность к восстановлению снижается и перелом срастется медленнее, клетки теряют способность к быстрому делению. Это доказывают микроскопические исследования, а также свойства костной ткани. Снижается степень минерализации коллагеновых волокон, поэтому травмы протекают длительнее.
Они формируют костный скелет тела человека. Для костной ткани характерна очень высокая степень минерализации (70%), в основном за счет фосфата кальция. Межклеточное вещество представлено преимущественно коллагеновыми волокнами, основного склеивающего вещества очень мало. Из органических веществ в основном преобладают коллагеновые белки.
Различают следующие виды костной ткани:
- грубо-волокнистую или ретикулярно-фиброзную ткань. Эта ткань имеется в эмбриогенезе. У взрослых из нее построены швы плоских костей черепа;
- пластинчатую костную ткань.
Клеточный состав этих двух видов тканей одинаков. Есть остеобласты – клетки образующие костную ткань. Они крупные, округлой или кубической формы, с хорошо развитым белоксинтезирующим аппаратом, вырабатывающим коллагеновые волокна. Этих клеток много в растущем организме и при регенерации костей. Остеобласты превращаются в остеоциты . У них мелкое овальное тело и длинные тонкие отростки, которые располагаются в костных канальцах, анастомозируют между собой. Эти клетки не делятся, не вырабатывают межклеточное вещество.
Остеокласты – очень крупные клетки. Они происходят из моноцитов крови, являются макрофагами костной ткани, многоядерные, в них хорошо развит лизосомальный аппарат и на одной из поверхностей имеются микроворсинки. Из клетки в зону микроворсинок выделяются гидролитические ферменты, которые расщепляют белковую матрицу кости, в результате чего высвобождается и вымывается из костей кальций.
Межклеточное вещество содержит коллагеновые (оссеиновые) волокна. Эти волокна широкие, лентовидной формы и в пластинчатой костной ткани располагаются паралелльно и прочно склеены между собой основным веществом. Именно эти волокна образуют костные пластинки.
В соседних костных пластинках коллагеновые волокна идут под разными углами, за счет этого достигается высокая прочность костной ткани. Между костными пластинками находятся тела остеоцитов, отростки которых пронизывают костные пластинки. В грубоволокнистой костной ткани костные волокна идут беспорядочно, переплетаются друг с другом и образуют пучки. Между волокнами залегают остеоциты.
Кости взрослого человека построены из пластинчатой костной ткани, причем она формирует компактное вещество кости, содержащее остеоны и губчатое вещество кости (в нем остеоны отсутствуют).
Эпифизы трубчатых костей построены из губчатой костной ткани, а диафизы – из компактного костного вещества.
Костная ткань обладает несколькими функциями. Прежде всего это опорная функция, обеспечивающая фиксацию внутренних органов, а также связок и мышц (опорно-двигательный аппарат). За счет опорной функции кости скелет выдерживает не только вес тела, но и большие нагрузки. Представляя собой подвижно соединенные в суставах рычаги различной длины, кости обеспечивают перемещение тела в пространстве за счет сократительной деятельности мышц. Защитная функция костной ткани наиболее наглядно проявляется по отношению к центральной нервной системе (головному и спинному мозгу) и костному мозгу, одетых сплошными костными чехлами. Обе указанные функции костной ткани могут быть названы механическими и их реализация связана с особенностями строения основных типов ткани - губчатой или трабекулярной и плотной или пластинчатой. Так, трабекулярная костная ткань, благодаря своему губчатому строению на концах длинных костей, гасит сотрясения, передаваемые через суставы, способна изгибаться и возвращаться к начальной форме. Пластинчатая плотная кость значительно более устойчива к изгибам и скручиванию. Помимо опорной и защитной, костная ткань выполняет в организме и другие функции: резервуарно-депонирующую и метаболическую, участвует в защите внутренней среды от хронического ацидоза, является ловушкой для попадающих в организм тяжелых металлов и радиоактивных изотопов, участвует в гистогенезе кроветворной ткани.
Кость - это непрестанно обновляемая ткань, в которой отдельные участки постоянно разрушаются, а на их месте образуются новые. В течение 10 лет у взрослого человека практически обновляется вся костная ткань (физиологическая регенерация). Следовательно, в костной ткани непрерывно сосуществуют два основных процесса: резорбция и формирование ткани. Эти процессы связаны с деятельностью клеток костной ткани: остеобластов, остеоцитов и остеокластов.
Костная ткань состоит из органического матрикса или остеоида, на долю которого приходится около 35% массы, и минерального компонента (65%). Функционально - структурной единицей компактной кости является остеон, представляющий собой концентрически расположенные пластинки вокруг гаверсова канала, в котором проходят кровеносные сосуды. В губчатой кости трабекулы находятся в полостях, включающих костный мозг, и окружены многочисленными кровеносными капиллярами. Органический матрикс синтезируется остеобластами, обладающими высокой синтетической деятельностью и секретирующими коллаген и протеогликаны, фосфолипиды и щелочную фосфатазу, необходимые для минерализации кости. При формировании кости остеобласты окружаются по периферии минерализованными участками ткани и превращаются в остеоциты, главной функцией которых является поддержание обмена веществ уже минерализованных костных участков. Третий тип клеток - остеокласты - располагается по поверхности кости в особых углублениях или нишах резорбции, образуемых за счет деятельности этих клеток. Остеокласты путем экзоцитоза выделяют Н-ионы, растворяющие минералы кости, секретируют лизосомальные ферменты (гидролазы и коллагеназы), разрушающие костный матрикс.
Различают пластинчатую и грубоволокнистую (ретикулофиброзную) костную ткани.
Грубоволокнистаякостная ткань (ретикулофиброзную) обнаруживается у плодов, а у взрослых – в местах прикрепления сухожилий мышц к костям, в местах зарастания черепных швов, в зубных альвеолах, в костном лабиринте внутреннего уха. В любом возрасте этот вид костной ткани может появляться в ответ на повреждение, в результате лечения, стимулирующего костеобразование, а также при нарушениях метаболизма, воспалительных и неопластических процессах.
Грубоволокнистая костная ткань характеризуется высокой скоростью формирования и обмена. Межклеточное вещество грубоволокнистой костной ткани состоит из мощных пучков коллагеновых волокон, расположенных параллельно или под углом друг к другу, большого количества протеогликанов и гликопротеинов и имеет низкое содержание минеральных солей.
Плотность расположения остеоцитов более высокая, чем в пластинчатой костной ткани. Остеоциты уплощены, лежат в лакунах и не имеют определенной ориентации по отношению к волокнам.
Пластинчатаякостная ткань отличается от ретикулофиброзной костной ткани упорядоченным расположением коллагеновых волокон в составе костных пластинок. Костные пластинки, в свою очередь, формируют параллельные концентрические слои – остеоны - структурно-функциональные единицы пластинчатой кости. Остеоны вместе с другими костными пластинками (наружные, внутренние периферические (генеральные) пластинки, интерстициальные пластинки) формируют основную массу компактной кости человека. Суммарно в составе компактной кости минеральный компонент матрикса по весу в процентном отношении несколько меньше органического.
Клетки костной ткани.
Клетки костной ткани происходят из двух клеточных линий: плюрипотентных мезенхимальных стволовых клеток и гемопоэтической стволовой клетки. Предшественники мезенхимальных клеток – «колониестимулирующие единицы» - дифференцируются в преостеобласты, располагающиеся вблизи костных поверхностей, которые при наличии соответствующих условий могут дифференцироваться в остеобласты. Дифферон костной ткани может быть представлен следующим рядом: остеогенная клетка (преостеобласт) остеобласт остеоцит .
Гемопоэтическая стволовая линия состоит из циркулирующих или костномозговых моноцитов, дифференцирующихся в преостеокласты и остеокласты. Мезенхимальные клетки, дифференцирующиеся в остеобласты, содержатся в костных каналах, эндосте, периосте и костном мозге. Еще один источник преостеобластов составляют васкулярные перициты. Клетки мезенхимы имеют неправильную форму, крупное ядро, окруженное узкой цитоплазмой, практически не содержащей мембранных органелл. На процесс дифференцировки клеток влияет щелочная фосфатаза, остеогенный фактор – костный морфогенетический белок (BMP–bonemorphogeneticprotein) иpO 2 (парциальное давление кислорода). При высоких значенияхpO 2 остеогенные клетки дифференцируются в остеобласты, при низких – в хондробласты.
Остеобласты относят к клеткам, формирующим костную ткань. Они располагаются на поверхности кости и плотно прилежат к соседним клеткам. Часть клетки, обращенная к новообразованному органическому матриксу, содержит преимущественно ГЭС, в то время как ядро находится на противоположном полюсе клетки. Остеобласты отличают по ассиметрично расположенному ядру. Основная функция остеобластов – синтез и секреция органического матрикса кости (коллагеновые и неколлагеновые белки), включающие внутри- и внеклеточные этапы. Внутриклеточный этап заключается в биосинтезе и процессинге коллагенаIтипа, секреции и экскреции его во внеклеточное пространство. Внеклеточный этап связан с формированием микрофибрилл, фибрилл и организации их в коллагеновые волокна, образующих сложно организованный коллагеновый каркас. Наряду с этим, остеобласты синтезируют и неколлагеновые белки (гликопротеины, остеонектин, остеокальцин, костный сиалопротеин, остеопонтин и др.), а также коллагеназу и активатор плазминогена. Маркером остеобластов является синтезируемый ими фермент щелочная фосфатаза. Остеобласты принимают участие в контроле обмена электролитов, минерализации кости посредством синтеза продуктов матрикса и образования матриксных везикул. Кроме того, системные факторы, в частности, паратгормон и цитокины могут стимулировать остеобласты к высвобождению факторов, активирующих остеокласты.
Остеобласты разделяют на активные и покоящиеся. Активные остеобласты формируют остеоид, период созревания которого около 10 суток.
Активные остеобласты– это крупные клетки кубической или цилиндрической формы диаметром 20 – 40 мкм, покрывающие 2 – 8% поверхности кости. Они имеют короткие микроворсинки, базофильную цитоплазму и эксцентрично расположенное ядро, богатое РНК. Ядро занимает до трети объема клетки и характеризуется преобладанием эухроматина над гетерохроматином, который беспорядочно распределен вдоль внутренней поверхности ядерной оболочки. В кариоплазме определяются одно или два ядрышка, окруженные гетерохроматином. В цитоплазме имеется хорошо развитая ГЭС с умеренной плотностью упаковки цистерн и канальцев, большое количество свободных рибосом и полирибосом. Митохондрии - преимущественно вытянутой формы, с низкими кристами, зачастую содержат кальций. Комплекс Гольджи хорошо развит и представлен уплощенными мешочками и секреторными пузырьками. Выявляются лизосомы и окаймленные пузырьки. В цитоплазме дифференцирующихся остеобластов определяются скопления гранул гликогена, которые, однако, отсутствуют в клетках, формирующих костную ткань. Имеются и липидные включения. Высока активность щелочной фосфатазы. Остеобласты выделяют матриксные пузырьки, содержащие липиды,Ca 2+ , щелочную фосфатазу и другие фосфатазы, что приводит к кальцификации остеоида. Минерализованный матрикс замуровывает клетку, и она превращается в остеоцит. Основной функцией активных остеобластов является синтез и секреция компонентов органического матрикса кости, выработка матриксных пузырьков, принимающих участие в минерализации, цитокинов и факторов роста. В активных остеобластах может снижаться синтетическая деятельность, и они превращаются в покоящиеся остеобласты или, продуцируя и окружая себя матриксом, - в остеоциты.
Наряду с остеокластами, резорбцию межклеточного вещества по стенкам канала остеона осуществляют и остеобласты. При интенсивной остеолитической активности группы рядом лежащих остеобластов, формируют лакуны остеобластической резорбции.
Покоящиеся остеобласты– это клетки, которые находятся на поверхности костной ткани, формируя своеобразную выстилку, играющую важную роль в обеспечении барьера крови – кость, но не принимают участия в формирования кости. Эти клетки имеют удлиненную и уплощенную форму, большое количество цитоплазматических островков, формирующих контакты с отростками других остеоцитов. Плотность расположения мембранных органелл в таких клетках по сравнению с активными остеобластами значительно снижена. Под влиянием паратиреоидного гормона эти клетки синтезируют ферменты, разрушающие остеоид, что в дальнейшем облегчает прикрепление остеокласта к костной ткани, и рассматривается как первый этап в резорбции кости.
Остеоциты – высокодифференцированные клетки, происходящие из остеобластов, окруженные минерализованным костным матриксом и располагающиеся в остеоцитарных лакунах, заполненных коллагеновыми фибриллами.
В зрелом скелете человека остеоциты составляют 90%. Клетки имеют вытянутую форму, размер около 15 × 45 мкм, содержат одно небольшое ядро, окруженное бедной органеллами цитоплазмой, в которой определяются округлой формы митохондрии и свободные рибосомы. Комплекс Гольджи развит слабо. Объем лизосом и ГЭС зависит от функционального состояния остеоцитов. От тел остеоцитов отходят длинные (50-60 мкм) цитоплазматические отростки, толщиной 5-6 мкм, располагающиеся в канальцах и анастомозирующие с соседними клетками. Плотность расположения остеоцитарных лакун высокая, около 25 000 на 1 мм 3 . Через цитоплазматические отростки осуществляется контакт остеоцитов между собой и с остеобластами эндоста или периоста. Контакты формируются на стадии остеоида, в последующем они образуют сеть, пронизывающую минерализованный костный матрикс (каналикулы). Периостеоцитарные пространства между плазматической мембраной остеоцита и матриксом содержат интерстициальную жидкость, по которой метаболиты поступают к клеткам. Общая плотность периостеоцитарных пространств в костях человека составляет от 1000 до 5000 м 2 , а объем – 1 – 1,5 л. В этих пространствах содержитсяCa 2+ , концентрация которого равна 0,5 ммоль/л, что практически в 3 раза ниже концентрации в плазме крови. Возможно, за счет этого осуществляется постоянный притокCa 2+ в костную ткань.
Основная функция остеоцитов – обеспечение обмена воды, белков и ионов в костной ткани. Остеоциты принимают участие в остеоплазии и остеолизе, хотя в отношении последнего имеются противоречивые точки зрения. Биосинтетическая активность остеобластов и остеоцитов, а в связи с этим и организация межклеточного вещества, зависят от величины и направленности вектора нагрузки, а также характера и величины гормональных влияний. В связи с этим костная ткань - это лабильная, интенсивно меняющаяся структура.
Остеокласты. Остеокласты - клетки, осуществляющие резорбцию костной ткани. Они возникают из гемопоэтических гранулоцитарно-макрофагальных колониеобразующих единиц (КОЕ), являющихся предшественниками моноцитов/макрофагов. Об этом свидетельствует экспрессия на мембранах остеокластов рецепторов Fc, СЗ и других мембранных маркеров макрофагов. В настоящее время не установлен механизм, который приводит к перемещению макрофагов между остеобластами к ненагружаемым участкам межклеточного вещества кости и к слиянию макрофагов с образованием многоядерных клеток - остеокластов. На их формирование влияют интерлейкин-3 и 1,25 дигидроксивитамин D 3 . Остеокласты - многоядерные крупные клетки размером до 150 - 180 мкм. В клетке может содержаться от 4 до 20 ядер. Ядра остеокластов практически одинаковой величины, формы и структуры. Они располагаются в центральной части клетки, имеют овально-вытянутую форму; эухроматин преобладает над гетерохроматином.
Остеокласты имеют куполообразную форму, с четкой дифференциацией структуры на 4 зоны: гофрированный край, светлую, везикулярную и базальную зоны. На рабочих участках плазмолемма остеокласта разделяется на светлую зону и гофрированный край.
Светлая зона - это зона прикрепления остеокласта к костной ткани. Благодаря плотному прикреплению создается замкнутое пространство, в котором поддерживается высокая концентрация катионов Н+ и протеолитических ферментов. В ней не содержится мембранных органелл, цитоплазма низкой плотности. В большом количестве определяются актиновые микрофиламенты, принимающие участие в формировании контакта остеокласта с поверхностью минерализованной кости. Адгезия остеокласта к костному матриксу опосредуется рецепторами. Для рецептора витронектина расшифрована специфическая аминокислотная последовательность белков матрикса - Arg-Gly-Asp.
Гофрированный край имеет мелкие выросты цитоплазмы различной величины, довольно плотно прилежащие друг к другу, направленные к поверхности кости, между которыми определяются фрагменты резорбируемого костного межклеточного вещества. Протяженность гофрированного края остеокластов днем в 2 раза больше, чем ночью. Эти данные коррелируют с циркадианным ритмом формирования костного матрикса и свидетельствуют о наличии биологического ритма резорбции кости остеокластами. Показано, что гофрированная каемка остеокластов является динамичной структурой и образуется только при контакте с костным межклеточным веществом, но отсутствует при перемещении остеокласта.
Рабочая часть поверхности остеокласта, как правило, глубоко погружена в резорбируемое межклеточное вещество, образуя остеокластическую лакуну резорбции (лакуну Хаушипа). В местах размещения нескольких остеокластов микроскопически определяется изъеденный за счет лакун контур межклеточного вещества костной ткани. В образовании резорбционной лакуны принимают участие ферменты тирозинкиназа, цистеиновые протеиназы. Кроме того, резорбционная активность остеокластов зависит от уровня коллагеназы, ионов водорода и кислородных свободных радикалов. Через мембрану остеокласта в области гофрированного края секретируется два типа продуктов, приводящих к деструкции костной ткани: через протонный насос выделяются катионы Н+, активация функционирования которого приводит к секреции протонов, закислению в очаге резорбции (рН снижается от 7 до 4) и растворению минералов кости. Катионы Н+ образуются из Н 2 СО 3 . Органический костный матрикс (остеоид) препятствует взаимодействию остеокластов с минерализованной костной тканью. Он разрушается катепсинами и коллагеназой, секретируемыми остеобластами и остеокластами.
Везикулярная зона остеокласта, расположенная вблизи гофрированного края, содержит многочисленные лизосомы. В базальной зоне остеокласта в цитоплазме обнаруживаются ядра, развитый комплекс Гольджи со значительным количеством цистерн и секреторных пузырьков и умеренно развитая ГЭС. Митохондрии определяются в довольно большом количестве между ядром и плазмолеммой на участках, противоположных рабочим, и являются показателем активности остеокластов. Остеокласты могут передвигаться с одного участка резорбции на другой. После выполнения резорбционной функции остеокласт может разделиться на мононуклеарные клетки. Регуляция функциональной активности остеокластов осуществляется остеобластами, системными и локальными факторами, представленными в таблице:
Факторы, регулирующие функциональную активность остеокластов
|
Факторы |
|
|
Стимулирующие |
Ингибирующие |
|
Системные |
|
|
Паратгормон (ПТГ) Кальцитриол (1,25(ОН) 2 D 3) Тироксин (Т 4) |
Кальцитонин Эстрогены Тестостерон |
|
Локальные |
|
|
Интерлейкины (IL-1, IL-3, IL-6, IL-11) Факторы некроза опухолей (TNF α , TNF β) Макрофагальный колониестимулирующий фактор (M-CSF) Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) Фактор стволовых клеток (SCF) Простагландины |
Интерферон γ(IFN Y) Трансформирующий фактор роста (TGF β) Интерлейкины (IL-4, IL-13) |
МАТРИКС КОСТНОЙ ТКАНИ
Матрикс костной ткани занимает 90% ее объема, остальная часть приходится на клетки, кровеносные и лимфатические сосуды. Костный матрикс состоит из органического и минерального компонентов. Неорганические компоненты составляют около 65% веса кости, органические компоненты - 20%, на долю воды приходится около 10%.
Органический матрикс. Основу органического матрикса (90%) составляет коллаген I типа с небольшим количеством (5%) коллагенов III, IV, V и XII типов. Коллаген I типа образует волокна с большим диаметром, что характеризует их прочность к растяжению и нагрузкам. Минерализация осуществляется вдоль фибрилл коллагена I типа. Остальные 5% составляют неколлагеновые белки (остеокальцин, остеонектин, костные сиалопротеины, костные фосфопротеины, костный морфогенетический белок, протеолипиды, гликопротеины и костно-специфические протеогликаны). Неколлагеновые белки влияют на формирование кости, минерализацию и активность клеток. Остеонектин обладает высоким сродством к костной ткани и коллагену I типа, регулирует рост кристаллов, что обусловливает его важную роль в кальцификации. Неколлагеновые белки (фибронектин, костный сиалопротеин, остеопонтин и тромбоспондин) обеспечивают межклеточные взаимодействия, ремоделирование костной ткани (остеокальцин), выступают как стимуляторы кальцификации (фосфопротеины). Костные протеолипиды, фосфопротеины связываются с кальцием, стимулируют минерализацию и рост кристаллов. Протеогликаны обеспечивают консолидацию коллагеновых фибрилл и связь коллагенов с кристаллической фазой матрикса. Низкомолекулярные протеогликаны влияют на формирование фибрилл коллагена I типа, стимулируют скорость их образования, а также прирост в толщину и длину. Структуре «коллаген-протеогликаны-кристалл» придается важная роль в обеспечении механических свойств костной ткани. Костный матрикс содержит цитокины и факторы роста, часть из которых является продуктом синтеза остеобластов; другие, вероятно, мигрируют в кость из прилежащих тканей. Такие факторы роста, как трансформирующий фактор роста бета (TGFβ) и инсулиноподобный фактор роста - 1 (GF-1) синтезируются остеобластами и стимулируют их рост по принципу аутокринного и (или) паракринного эффекта.
Неорганический матрикс. Минеральный компонент межклеточного вещества бывает в двух основных формах - аморфной и кристаллической. Аморфный фосфат кальция составляет 60% минеральной фазы. Это гранулы округлой формы размером от 5 до 20 нм. Растворимость фосфата кальция выше, чем у апатита, что имеет важное биологическое значение для обеспечения постоянства концентрации кальция в интерстициальной жидкости. Он представляет собой лабильный резерв ионов кальция и фосфора. Аморфный фосфат кальция - продукт жизнедеятельности костной клетки и его осаждение также регулируется клеткой. 6% объема минеральной фазы составляет СаСОз, около 1,5% - MgPО 4 . В костной ткани содержатся: свинец (хлориды и фториды), стронций, радий, барий, калий и натрий. Последний составляет около 50% всей его массы в организме. Небольшая доля приходится на окта-, ди-, три-, β-трикальцийфосфат, брунеит и другие вещества. Значительный объем в кости занимают кристаллы гидроксиапатита размером от 10 до 150 нм. С особенностью организации кристаллической фазы кости связаны основные функциональные свойства - прочность, метаболизм, жизнеспособность и др. Показано, что при остеопорозе изменяются размеры кристаллов гидроксиапатита, их физико-механические и биохимические свойства.
Минерализация костной ткани. Механизмы минерализации кости до конца не раскрыты. Предполагают, что существует несколько механизмов биоминерализации. На основе одних механизмов осуществляется минерализация пластинчатой костной ткани, других - хрящевой ткани и грубоволокнистой костной ткани.
Минерализация пластинчатой костной ткани протекает следующим образом. Вначале осуществляется биосинтез коллагена, ГАГ, протеогликанов и гликопротеинов. Коллаген определенным образом располагается в костной ткани. Согласно этой модели, молекулы коллагена перекрываются лишь на 9% их длины. Линии молекул располагаются уступами латерально и формируют фибриллы с отверстиями между концами молекул - зоны отверстий, а область, состоящая из неперекрывающихся молекул, названа зоной перекрытия. Минеральные вещества, имеющиеся в костной ткани, откладываются внутри фибрилл и между ними (преимущественно в зоне отверстий), с последующим распространением в противоположном направлении от зоны перекрытий вплоть до полной минерализации фибриллы. Периодичность минеральной фазы равна около 70 нм, т. е. соответствует периоду коллагеновых фибрилл.
Транспорт остеотропных ионов исследован с помощью радионуклида 45 Са. Фракция, содержащая кальций, переносится через эндотелиальную стенку гемокапилляра в межклеточное пространство, откуда перемещается в остеобласты. Через 15 мин. после введения 45 Са 60% метки выявляется над остеобластами, а через 40 мин. почти в одинаковой концентрации метка обнаруживается над клетками и над ближайшими областями межклеточного вещества. Через 6 ч более 60% метки определяется над межклеточным веществом. Помимо опосредованного транспорта (межклеточное пространство → остеогенные клетки → костный матрикс) допускается прямой путь через межклеточное пространство в костный матрикс. Морфологически участки минерализации представляют собой электронно-плотные частицы, расположенные между коллагеновыми волокнами.
Существенную роль в процессах биоминерализации хрящевой ткани и грубоволокнистой костной ткани играют матриксные пузырьки, или везикулы, насыщающие органический матрикс кристаллами гидроксиапатита, что создает условия для формирования кристаллов. Матриксные пузырьки представляют собой небольшие образования (около 100 нм и более в диаметре), которые отделяются от клеточной мембраны в межклеточное пространство путем экзоцитоза. В матриксе они служат ядрами формирования кристаллов гидроксиапатита. Первичные ядра минерализации возникают на реакционноспособных группах нативных коллагенов фибрилл, комплексообразующие группировки которых обладают высоким сродством к различного рода минералам. Однако эти реакционноспособные группы блокированы сульфатированными ГАГ, обеспечивающими пространственную ориентацию макромолекул коллагена и насыщение их макро- и микроэлементами. С участием гиалуронидаз и протеаз происходит деполимеризация кислых ГАГ с освобождением аминогрупп, которые связывают Са 2+ и РО 4 3- с образованием ядер кристаллизации.
Согласно другой гипотезе, основную роль в минерализации играют ферменты: щелочная фосфатаза, АТФаза, фосфорилаза - отщепляющие неорганический фосфат от органического субстрата. В частности, щелочная фосфатаза высвобождает неорганический фосфат из эфиров. В результате формируется локальный избыток ионов фосфора и кальция, и образуются преципитаты фосфора и кальция. Кроме того, щелочная фосфатаза действует как трансфераза и обеспечивает фосфорилирование коллагена. Минерализация коллагена I типа начинается на поверхности фибрилл, а затем распространяется вглубь, формируя непрерывную минеральную фазу. Определенную роль в процессе связывания ионов играет остеокальцин, главный неколлагеновый белок кости, и β-глицерофосфат.
Важным процессом, происходящим при минерализации, является разрушение ингибиторов минерализации. По мнению одних исследователей, в такой роли выступают протеогликаны, которые разрушаются деполимеризующими ферментами типа гиалуронидазы и протеазы. Другие полагают, что ингибиторами кальцификации коллагена являются пирофосфаты, фосфонаты и дифосфонаты. Инактивация этих ингибиторов происходит под воздействием фермента пирофосфатазы, разрушающего неорганический пирофосфонат.
Таким образом, процесс минерализации является как ферментативным, так и физико-химическим. Вокруг сформировавшихся кристаллов гидроксиапатита удерживается гидратный слой, что обеспечивает условия для быстрого обмена неорганических ионов между поверхностным слоем кристалла, гидратной оболочкой и внеклеточной жидкостью. Интенсивность обмена кальция между внеклеточной жидкостью и минерализованным матриксом зависит от концентрационных различий в солевом составе кости, плазмы крови, а также от активности метаболических процессов, происходящих в клетках. С повышением минерализации костной ткани снижаются микроциркуляция, диффузия и обмен ионов.
СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ЕДИНИЦЫ
Исходной структурно-функциональной единицей опорных структур в губчатом веществе кости является костная перекладина, или трабекула , образованная костной тканью, а в компактной кости - остеон. Основным формообразующим фактором костной трабекулы является вектор нагрузки, величина и направленность которого определяет ориентацию макромолекулярных компонентов межклеточного вещества. Костная трабекула формируется как пространственная система, противодействующая вектору нагрузки. Перестройка костной трабекулы осуществляется за счет остеосинтетической и остеолитнческой активности остеобластов, остеоцитов и остеокластов. Отложение новообразованного костного межклеточного вещества на поверхности костной трабекулы в одних участках и рассасывание в других дают возможность в сравнительно короткие сроки существенно изменить ориентацию костной трабекулы. Наименее нагружаемые участки подвергаются рассасыванию с помощью остеокластов. Вместе с тем, следует отметить, что костная трабекула может иметь различную форму, обеспечивая выполнение опорной функции только при противодействии одному вектору, т.е. в одной плоскости. Учитывая, что организм человека испытывает действие векторов нагрузки как минимум в трех плоскостях, костная трабекула является исходной структурой для более сложных трехмерных опорных конструкций.
Такой конструкцией является костная ячейка , которую в идеальном приближении можно считать кубом, имеющим вход во внутреннее пространство через одну из стенок, Костные трабекулы одной стенки переходят без границы в костные трабекулы других стенок. Костная ткань ячеек окружена средой: по наружной поверхности - это соединительная, а по внутренней - ретикулярная ткани. Все остальные тканевые компоненты – микроциркуляторное русло, нервные элементы и клетки иммунной системы располагаются в ячейке и вблизи костной трабекулы.
Следует подчеркнуть две особенности. Одна заключается в том, что в момент формирования ячейки лимфатические капилляры образуются только по ее наружной поверхности, а не внутри ее и, таким образом, внутриячеистого лимфатического русла нет. Артериальный приток в пространстве внутри ячейки происходит под несколько большим давлением и это обусловливает повышенное давление тканевой жидкости во внутриячеистом пространстве, препятствует формированию лимфатических капилляров. Вторая особенность связана с тем, что пространство внутри ячейки оказывается благоприятной средой для очагов кроветворения.
Высокие биомеханические качества костных ячеек определяют возможность построения из них крупных и прочных макроскопических опорных структур и, в связи с этим, большинство коротких костей построены из ячеек. В длинных костях, где величины нагрузок существенно возрастают, система ячеек не обеспечивает необходимую прочность, и они трансформируются в многослойные разветвленные трубчатые системы – остеоны, формирующие пластинчатую костную ткань. Взаимоотношения между структурно-функциональными единицами кости складываются на этапах развития костей скелета в зависимости от распределения вектора нагрузки. В связи с этим эпифизы построены из ячеек, а в метадиафизе определяется переход от ячеек к остеонам. Диафизы костей состоят из остеонов, наружных и внутренних генеральных пластинок, а во внутреннюю полость кости обращены отдельные костные трабекулы.
Остеон состоит из системы связанных между собой костных пластинок, окружающих центральный канал. Остеоциты располагаются между слоями костных пластинок. Снаружи остеон ограничен линией цементации, отделяющей его от других остеонов. Центральный канал заполнен соединительной тканью, в которой размещаются кровеносные лимфатические сосуды и нервные волокна.
Используя тетрациклиновую метку, было доказано, что время образования остеонов в семилетнем возрасте составляет около 40 суток, а после 40 лет увеличивается до 79 суток. Остеон представляет собой такую же динамичную структуру, как и костная пластинка и ячейка, и в ответ на увеличение нагрузки происходит образование новых слоев костной ткани по внутренней поверхности его центрального канала, что ведет к возрастанию количества пластинок и сужению просвета канала. При уменьшении нагрузки остеолитическая деятельность остеобластов внутренней поверхности канала ведет к уменьшению количества пластинок у остеонов и расширению просвета центрального канала.
Остеоны разделяют на три группы: 1) растущие остеоны с хорошо выраженным центральным каналом и узким ободком остеоидной костной ткани под слоем остеобластов. Сосуды канала, как правило, расширены и заполнены кровью; 2) зрелые, покоящиеся остеоны, с узким просветом центрального канала, слабо выраженным слоем уплощенных остеобластов и с суженным просветом сосудов; 3) представлена остеонами резорбционного типа, которые характеризуются расширенным центральным каналом, имеющим неровные контуры в связи с резорбцией костной ткани остеобластами. В просвете центрального канала определяется значительное количество клеточных элементов, расширенные и заполненные кровью сосуды. Изменение величины нагрузки создает условия для перехода от растущих остеонов к зрелым формам и от зрелых к резорбционным, а также от резорбционных остеонов к зрелым, что создает гетероморфность остеонов в пределах кости. Перестройка остеонов продолжается всю жизнь. Число остеонов, приходящихся на единицу площади среза в пластинчатой кости, с годами уменьшается. Кроме того, в молодом возрасте остеоны имеют более крупные размеры, а в старческом их диаметр значительно уменьшен, а по внутренней поверхности формируется гиперкальцифицированное кольцо. Резорбцию межклеточного вещества по стенкам канала остеона осуществляют остеокласты и остеобласты. Между остеонами располагается слой пластинок, получивший название вставочные. Коллагеновые волокна в костных пластинках имеют упорядоченное расположение - под углом к волокнам соседних пластинок, что обеспечивает прочностные свойства. Здесь же обнаруживаются костные канальцы, содержащие отростки остеоцитов. Тела остеоцитов располагаются в лакунах.
Интерстициальные каналы компактной кости включают два звена микроциркуляции, которые являются единой трофической системой. Первое звено - это центральные, прободающие и соединительные каналы, содержащие кровеносные сосуды. Центральные каналы располагаются в центре остеона, имеют различный диаметр (от 30 до 150 мкм), стенки этих каналов образованы костными пластинками. Они ориентированы, в основном, вдоль длинной оси кости, и лишь отдельные из них имеют тангенциальную ориентацию. Прободающие каналы (диаметр от 30 до 60 мкм) располагаются в кости по направлению от периоста и эндоста к центральным каналам. Соединительные каналы выполняют роль анастомозов между центральными каналами.
Второе звено - лакунарно-канальцевая система, которая обеспечивает обмен между остеоцитами и кровью. Лакуны остеоцитов в кости разделяют на 5 типов в зависимости от функциональной активности клеток: 1) неактивная лакуна, имеющая ровные границы, характеризует фазу покоя остеоцитов, на этой фазе поддерживается тонкая регуляция гомеостаза кальция и фосфора; 2) остеолитическая лакуна - лакуна больших размеров и неправильной формы, остеоциты, располагающиеся в таких лакунах, содержат большое количество лизосом и осуществляют периостеоцитарный остеолиз (синоним: остеоцитарная остеоклазия); 3) остеопластическая лакуна - по стенкам лакуны определяется большое количество новообразованных радиально расположенных коллагеновых волокон; методом тетрациклиновой метки доказано, что разрушение кости и ее созидание происходят синхронно, остеоциты, располагающиеся в таких лакунах, содержат развитую ГЭС; 4) пятнистая лакуна, остеоциты, располагающиеся в лакуне, окружены ореолом из кальцифицированного и некальцифицированного матрикса, обычно такие лакуны определяются в костной ткани при патологических состояниях (флюорозе, рахите и др.); 5) пустая лакуна, содержащая продукты распада остеоцитов; после гибели остеоцитов такие лакуны окружены сверхминерализованной мертвой тканью.
Клеточные лакуны соединяются с канальцами, формируя единую лакунарно-канальцевую систему.
Надкостница (периост). На поверхности кости формируется надкостница. В ней различают два слоя - внутренний остеогенный (камбиальный) и наружный фиброзный.
Внутренний слойнадкостницы включает остеогенные клетки, которые способны дифференцироваться в хрящевые или костные. Клеточные элементы надкостницы располагаются в три слоя: первый состоит из преостеобластов, мелких стволовых клеток; второй - из остеобластов, между которыми располагаются капиллярные петли, и третий - из фибробластов, формирующих коллагеновый каркас. Ультраструктура этих клеток вариабельна и зависит от степени дифференцировки. Цитоплазма у малодифференцированных клеток базофильна, определяется высокая плотность свободных рибосом, что свидетельствует об интенсификации ростовых процессов. По мере дифференцировки клеток возрастает объем ГЭС. Клетки остеогенного слоя надкостницы принимают участие в процессах перестройки кости, при развитии и росте.
Наружный слойнадкостницы представлен плотной волокнистой соединительной тканью, состоящей из коллагеновых волокон, небольшого числа эластических волокон и фибробластов. Надкостница содержит сосуды, переходящие в мягкие ткани. В наружном слое надкостницы имеется сеть лимфатических сосудов. В остеогенном слое капиллярные петли располагаются межу остеобластами. Надкостница прочно крепится к поверхности кости за счет пучков прободающих волокон (волокон Шарпея).
Эндост. Со стороны костного мозга кость выстлана тонкой оболочкой, аналогичной периосту. Однако граница между наружным и внутренним слоями менее выражена. В покоящейся кости в нем обнаруживается непрерывный слой неактивных плоских остеогенных клеток. Слой остеогенных клеток может быть нарушен деятельностью остеокластов, выполняющих резорбцию костного матрикса для пополнения потребности организма в кальции. Остеогенные потенции клеток эндоста проявляются в условиях резорбции, при переломах, развитии и росте.
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ И ФИЗИОЛОГИЧЕСКАЯ РЕГЕНЕРАЦИЯ
Кости у мужчин и женщин формируются приблизительно до 25 лет. До 40 лет масса костной ткани практически не изменяется, а затем - до 50 лет идет ее небольшая потеря (до 0,4% в год). У женщин потеря костной ткани более высокая и составляет 0,9-1,1%. К 90 годам у мужчин убыль костной ткани достигает 18,9%, в то время как у женщин - 32,4%. Изменения в губчатой кости происходят намного раньше, чем в компактной. Количество трабекул уменьшается на 45% при постклимактерических остеопорозах.
Костная ткань - динамическая система, которая на этапах развития и зрелости характеризуется определенным соотношением компонентов и обновлением. Так, остеокальцин, например, в 50-100 раз больше связывается со зрелой костью, чем с эмбриональной. В надкостнице с повышением возраста не определяется митотическая активность в остеобластическом слое. Снижается плотность расположения остеобластов на поверхности кости. Остеоциты местами разрушаются и в составе костной ткани обнаруживаются участки с пустыми лакунами остеоцитов. В связи с непрекращающимся переходом органических и минеральных компонентов межклеточного вещества в сосуды происходит сначала истончение, а затем рассасывание костных структур (возрастной остеопороз).
За счет снижения активности биосинтетических процессов в клетках в межклеточном веществе уменьшается содержание хондроитинсульфатов, играющих важную роль в кальцификации. Это приводит к формированию слабо- и среднеминерализованных остеонов. Накопление в субпериостальных областях кости кератансульфатов нарушает периостальное костеобразование, что приводит к снижению механической прочности кости и к переломам. Качественные изменения выражаются в уменьшении доли гликопротеидов и в возрастании роли коллагеновых белков в составе органического матрикса. Это ведет к уменьшению содержания воды и при несущественном изменении прочности ткани к статическим нагрузкам, уменьшается ее прочность к динамическим нагрузкам, т. е. возрастает хрупкость кости. Количественные изменения проявляются в уменьшении доли костной ткани в объеме участка кости.
Перестройка (ремоделирование) костной ткани. Продолжительность резорбции у пациентов среднего возраста в губчатой кости составляет 40-50 сут., в компактной - 30 сут. В этом возрасте скорость обновления скелета составляет в среднем 8% массы костной ткани в год (в компактном веществе кости - около 4%, в губчатом - около 20%).
В физиологических условиях процессы ремоделирования, протекающие в костной ткани, должны обеспечить как структурно-поддерживающую функцию скелета, так и выполнение метаболической роли в минеральном гомеостазе. Ремоделирование губчатой кости происходит в несколько стадий: активация, резорбция, формирование остеоида и его минерализации. Первая стадия - активация остеокластов. На этой стадии к фокальному участку кости прикрепляются остеокласты. Фактор, который инициирует прикрепление остеокластов к кости, в настоящее время не установлен, но возможно, что микроповреждения кости могут явиться сигналом к их стимуляции. Вторая стадия ремоделирования - это формирование локуса резорбции. Полость глубиной 40-60 мкм формируется в течение 4-12 сут. В следующие 7-10 сут. на границе этой области накапливаются протеогликаны, глипротеины и кислая фосфатаза, но практически не определяется коллаген. Эта фаза является пограничной между резорбцией костной ткани и ее формированием. На третьей фазе происходит образование остеоида. Формируются линии цементации, в матриксе появляются такие белки как коллаген, трансформирующие факторы роста. Объем новообразованного остеоида зависит от количества и активности остеобластов, в нем в поляризованном свете можно обнаружить характерное расположение пучков коллагеновых волокон. Последняя стадия - минерализация остеоида. Первой ступенью в кальцификации является появление матриксных везикул, богатых щелочной фосфатазой, остеокальцина и др.
Ремоделирование пластинчатой кости представляет синхронный процесс разрушения-созидания остеонов.
Разработана концепция взаимодействия клеточных популяций при ремоделировании кости, которая основана на оценке единиц ремоделирования - базисной многоклеточной единицы (BMU), костной ремоделирующей единицы (BRU) и костной структурной единицы (BSU).
Согласно этой концепции, BMU - комплекс клеток (в основном, остеобластов и остеокластов), которые участвуют в локальных процессах резорбции и формирования кости. В нормальной костной ткани имеет место четкая взаимосвязь и взаимозависимость процессов резорбции и восстановления. Новая костная ткань формируется лишь на тех участках, где имели место процессы резорбции. Величина BMU у здоровых людей является постоянной по времени образования. С возрастом у человека изменяются следующие параметры: удлиняется время, требуемое на завершение образования одной единицы; уменьшается число новых BMU, которые формируются в единицу времени. Это приводит к снижению интенсивности ремоделирования в физиологических условиях. BRU - это компоненты перестраивающейся костной ткани. Суммарной активностью результатов ремоделирования является BSU. В случае компактной кости в качестве BSU выступает формирование вторичных остеонов. В губчатой кости BSU занимает площадь 0,5-1 мм 2 .
В скелетной ткани насчитывается около 35 миллионов BSU, каждая - объемом 0,05 мм 3 , 40% из них приходится на губчатую костную ткань. При нормальном росте и развитии подростков и лиц до 35 лет характерно повышенное костеобразование, что приводит к увеличению массы кости. При остеопенических состояниях, болезни Педжета, остеопетрозе и остеопорозах различного происхождения имеет место нарушение процессов ремоделирования. Так, при болезни Педжета уровень костеобразования значительно увеличен по сравнению с нормой, повышены и процессы резорбции. Развитие остеосклероза при остеопетрозе связано с нарушением функции остеокластов.
Для остеопороза, который возникает вследствие хронического применения глюкокортикоидов, характерно снижение костеобразования и увеличение активности процессов резорбции. Постклимактерические остеопорозы характеризуются тем, что уровень костеобразования может не отличаться от нормы, но значительно увеличивается резорбция костной ткани. В условиях гиперпаратиреоза, гипертиреоза, хронического недостатка кальция в организме, рассасывание превалирует над костеобразованием. Ситуация, которая связана с повышением резорбции и костеобразования, характерна для процессов заживления переломов. Для людей зрелого возраста или при аутосомно-доминантной форме остеопетроза характерен высокий уровень формирования кости и низкий уровень резорбции, что приводит к увеличению массы костных трабекул. В условиях сенильных остеопорозов уровень костеобразования значительно снижен, а резорбции - повышен. При медикаментозной терапии эстрогенами, а также солями кальция у пациенток с постменопаузальным остеопорозом отмечается положительный баланс процессов перестройки костной ткани, при этом уровень формирования кости соответствует норме, а уровень резорбции уменьшается. При нарушении процессов минерализации повышенное образование остеоида за счет высокой биосинтетической активности остеобластов может приводить к остеомаляции.
Гормональный контроль ремоделирования. Среди гормонов наиболее существенное влияние на метаболизм костной ткани и гомеостаз кальция оказывает паратгормон, витамин D и его метаболиты, и, в меньшей степени, кальцитонин. То или иное участие принимают почти все другие гормоны, продуцируемые железами организма, медиаторы и модуляторы.
Паратгормон. Паратгормон связывается преимущественно с клетками, располагающимися между матриксом кости и сосудами. Они отличаются от остеобластов ультраструктурной организацией - богаты гранулами гликогена, имеют вытянутые митохондрии, развитый комплекс Гольджи и большое количество микротрубочек. По локализации и строению такие клетки могут быть отнесены к преостеобластам. В меньшей степени метка гормона обнаруживалась в остеоцитах. Общий принцип действия паратгормона заключается в том, что он связывается со специфическими рецепторами цитоплазматической мембраны, активизирует аденилатциклазу, что сопровождается повышением уровня цАМФ в клетках. Одновременно стимулируется поступление ионов кальция в клетку, подавление биосинтеза щелочной фосфатазы и коллагена. На более поздних этапах увеличивается выход ионов кальция из кости и повышение их концентрации в крови. Предполагается, что стимулированные паратгормоном остеобласты выделяют цитокины, которые активируют остеокласты и их предшественники. В экспериментах in vitro доказано, что клетки остеобластического ряда при действии паратгормона выделяют фактор, стимулирующий колониеобразование гранулоцитов и макрофагов. Под влиянием паратгормона повышается митотическая активность остеобластов, что ведет к увеличению их количества. Усиливается остеолитическая активность остеобластов и остеоцитов. Этот процесс сопровождается рассасыванием костного межклеточного вещества и поступлением компонентов органического и неорганического матрикса кости в гемокапилляры. Остеокласты также реагируют на введение паратгормона. В них обнаруживается увеличение поверхности гофрированной каемки цитоплазматической мембраны, прилежащей к кости. При длительном введении этого гормона происходит увеличение количества остеокластов. Механизм этого процесса неизвестен.
Кальцитонин. Действие гормона парафолликулярных эндокриноцитов щитовидной железы - кальцитонина - заключается в ингибировании остеокластической резорбции костной ткани. Он способствует уменьшению гофрированной каемки остеокластов. Под влиянием кальцитонина повышается активность остеобластов и остеоцитов, что ведет к интенсивному перемещению молекул, необходимых для биосинтеза костного межклеточного вещества, из сосудистого русла в матрикс, способствуя насыщению межклеточного вещества органическими и минеральными компонентами и к возрастанию прочности костных структур. Кальцитонин тормозит выход органических веществ и минеральных компонентов из клеточного матрикса. Наиболее существенное влияние паратгормона и кальцитонина зафиксировано по уровню изменения концентрации ионов Са 2+ . За счет постоянного, но разнонаправленного действия паратгормона и кальцитонина, в организме удерживается постоянство концентрации ионов Са 2+ в крови несмотря на колебания в поступлении и потреблении этих ионов всеми клетками организма.
Витамин D и его метаболиты. На костную ткань оказывают прямое действие витамин D и его метаболиты. Витамин D представляет собой смесь витамина D 3 и витамина D 2 . D 3 образуется в коже под влиянием ультрафиолетового облучения, а D 2 - из эргостерина пищевых продуктов. Основное действие витамина D на костную ткань - это обеспечение ионами Са 2+ и РО 4 3- за счет стимуляции их всасывания в кишечнике. Витамин D и его метаболиты усиливают остеокластическую резорбцию кости, уменьшают синтез коллагена остеобластами, стимулируют биосинтез инсулиноподобного фактора роста-I.
Гормон роста. Важным фактором, оказывающим выраженное действие на развитие костных тканей у детей, является гормон роста. У взрослых за счет стимуляции им процессов костеобразования, увеличивается масса кости, а это приводит к деформациям кости. Гормон роста не влияет на течение процессов резорбции. Его действие опосредуется рецепторами на остеобластах, продуцирующих инсулиноподобные факторы роста.
Глюкокортикоиды. Глюкокортикоиды оказывают выраженное действие на формирование костной ткани. Они могут, как стимулировать, так и ингибировать процессы резорбции. Для роста костных тканей необходимы низкие дозы глюкокортикоидов, оказывающих стимулирующее действие на биосинтез коллагена. Избыток глюкокортикоидов ингибирует биосинтез коллагена и инсулиноподобного фактора роста-I, что снижает рост костей.
Половые гормоны. Эстрогены и андрогены стимулируют процесс костеобразования, принимают участие в росте костей и закрытии эпифизарной зоны роста. Доказано, что у женщин эстрогены замедляют процессы резорбции костной ткани.
Тиреоидные гормоны. Костная ткань чувствительна к изменению уровня в крови тиреоидных гормонов. Так, их дефицит приводит к нарушению развития центров оссификации, а при избытке - стимулируется остеокластическая резорбция костной ткани, что сопровождается снижением плотности кости.
Инсулин и глюкагон. Механизм действия инсулина и глюкагона на костные ткани изучен недостаточно. Выявлено, что недостаток инсулина у детей приводит к замедлению роста, в связи с чем он рассматривается как важный системный гормон, регулирующий рост костей. Инсулин стимулирует биосинтез макромолекул матрикса костей и хрящей, а также процессы минерализации костной ткани. В резорбции кости непосредственного участия принимает.
Глюкагон ингибирует резорбцию кости в культуре ткани, но в организме стимулирует секрецию кальцитонина и через него влияет на остеогенез.
Локальные регуляторы ремоделирования. Простагландины (ПГ). В настоящее время установлено, что в регуляции метаболических процессов костной ткани принимают участие и факторы микроокружения, в частности, ПГ. Клетки костной ткани продуцируют простаноиды, из которых наиболее изучены ПГЕ 2 . ПГ модулируют различные процессы, включая воспаление, кровообращение и ионный транспорт через клеточные мембраны. Экзогенные ПГЕ 2 стимулируют биосинтез коллагена, пролиферацию и цитодифференцировку клеток периоста, что приводит к утолщению кости за счет развития периостальных напластований. При этом в самой костной ткани при экзогенном воздействии ПГЕ 2 происходит стимуляция процессов резорбции, что сопровождается выделением из кости кальция и магния. Возможно, ПГ регулируют дифференцировку остеобластов и выступают как агенты локального контроля за остеокластической резорбцией кости. ПГ, подобно паратгормону, повышают уровень цАМФ, индуцируя остеобласты к стимуляции активности остеокластов. В экспериментальных условиях доказана связь между продукцией ПГ макрофагами и фактором, активирующим остеокласты, который продуцируется лимфоцитами. Этот механизм может иметь место при резорбции кости вследствие хронического воспалительного процесса или при предопухолевом состоянии.
Инсулиноподобные факторы роста существуют в двух формах (IGF-1, IGF-2). IGF-1 стимулирует биосинтез и ингибирует деградацию коллагена и других компонентов матрикса, стимулирует пролиферацию остеобластов.
Трансформирующий фактор роста-β. Имеется 5 разновидностей данного фактора. Их биологические эффекты связаны с регуляцией пролиферативной активности остеобластов. Они стимулируют биосинтез коллагена I типа, остеопонтина, секрецию цитокинов, щелочной фосфатазы, продукцию ПГЕ 2 и ингибируют выработку остеокальцина.
Факторы роста фибробластов обнаруживаются в костях. Они стимулируют в костных клетках биосинтез коллагена I типа.
Тромбоцитарный фактор роста регулирует костную резорбцию и репликацию костных клеток.
На синтез ДНК и коллагена в остеобластах выраженное действие оказывает интерлейкин-1. Остеобластическая резорбция кости, опосредованная паратгормоном, может стимулироваться остеокальцином.
К местным факторам, стимулирующим резорбцию кости, относят и повышенное напряжение кислорода, натяжение и сдавливание кости, как факторы, модифицирующие активность клеток. Известно, что в кости при приложении к ней внешних сил или сдавливании, возникает «пьезоэлектрический эффект», а на границе твердого вещества с жидкостью - «электрокинетический феномен». Механизмы резорбции костной ткани и вклад биоэлектрических потенциалов в этот процесс нуждаются в дальнейшей уточнении, хотя метод электростимуляции положительно зарекомендовал себя при лечении переломов кости.
Костная ткань обладает несколькими функциями. Прежде всего это опорная функция, обеспечивающая фиксацию внутренних органов, а также связок и мышц (опорнодвигательный аппарат). За счет опорной функции кости скелет выдерживает не только вес тела, но и большие нагрузки. Представляя собой подвижно соединенные в суставах рычаги различной длины, кости обеспечивают перемещение тела в пространстве за счет сократительной деятельности мышц. Защитная функция костной ткани наиболее наглядно проявляется по отношению к центральной нервной системе (головному и спинному мозгу) и костному мозгу, одетых сплошными костными чехлами. Обе указанные функции костной ткани могут быть названы механическими и их реализация связана с особенностями строения основных типов ткани - губчатой или трабекулярной и плотной или пластинчатой. Так, трабекулярная костная ткань, благодаря своему губчатому строению на концах длинных костей, гасит сотрясения, передаваемые через суставы, способна изгибаться и возвращаться к начальной форме. Пластинчатая плотная кость значительно более устойчива к изгибам и скручиванию. Помимо опорной и защитной, костная ткань выполняет в организме и другие функции: резервуарнодепонирующую и метаболическую, участвует в защите внутренней среды от хронического ацидоза, является ловушкой для попадающих в организм тяжелых металлов и радиоактивных изотопов, участвует в гистогенезе кроветворной ткани.
Кость - это непрестанно обновляемая ткань, в которой отдельные участки постоянно разрушаются, а на их месте образуются новые. В течение 10 лет у взрослого человека практически обновляется вся костная ткань (физиологическая регенерация). Следовательно, в костной ткани непрерывно сосуществуют два основных процесса: резорбция и формирование ткани. Эти процессы связаны с деятельностью клеток костной ткани: остеобластов, остеоцитов и остеокластов.
Костная ткань состоит из органического матрикса или остеоида, на долю которого приходится около 35% массы, и минерального компонента (65%). Функционально структурной единицей компактной кости является остеон, представляющий собой концентрически расположенные пластинки вокруг гаверсова канала, в котором проходят кровеносные сосуды. В губчатой кости трабекулы находятся в полостях, включающих костный мозг, и окружены многочисленными кровеносными капиллярами. Органический матрикс синтезируется остеобластами, обладающими высокой синтетической деятельностью и секретирующими коллаген и протеогликаны, фосфолипиды и щелочную фосфатазу, необходимые для минерализации кости. При формировании кости остеобласты окружаются по периферии минерализованными участками ткани и превращаются в остеоциты, главной функцией которых является поддержание обмена веществ уже минерализованных костных участков. Третий тип клеток - остеокласты - располагается по поверхности кости в особых углублениях или нишах резорбции, образуемых за счет деятельности этих клеток. Остеокласты путем экзоцитоза выделяют Нионы, растворяющие минералы кости, секретируют лизосомальные ферменты (гидролазы и коллагеназы), разрушающие костный матрикс.
В надкостнице находится популяция стволовых остеогенных клеток, сохраняющих способность к пролиферации на протяжении всей жизни. За счет этих клеток происходит образование новых слоев костной ткани снаружи (в периосте), при одновременной резорбции костной ткани изнутри (эндоосте). Так растет кость в ширину, при этом костномозговой канал расширяется, а толщина стенки трубчатой кости практически не меняется. В процессе роста костей в длину важную роль играет хрящевая ткань эпифазарных концов, образующая зоны роста за счет способных к пролиферации хондроцитов.
Для роста костной ткани важное значение имеют особенности кровообращения. Это связано с несколькими механизмами. Вопервых, кровоток обеспечивает обмен кальция и фосфора между кровью и костной тканью, необходимый для постоянного обновления кости. Вовторых, кровоток приносит в костную ткань органические субстраты метаболизма и, прежде всего, глюкозу, высокое потребление которой костной тканью обусловлено низким содержанием в притекающей крови кислорода и гликолитическим путем получения энергии. Глюкоза используется также для синтеза гликогена, необходимого для процессов минерализации растущей кости. Втретьих, поступающая в кость кровь имеет высокое напряжение углекислого газа, что является одним из факторов, способствующих костеобразованию. Вчетвертых, кровоток создает в растущей костной ткани электрохимический потенциал, способствующий преципитации солей и образованию очагов кальцификации.
Повышение кровотока активизирует рост костей в длину. В условиях механических нагрузок кровоток возрастает, что стимулирует рост кости. Механические нагрузки повышают процессы костеобразования и благодаря пьезоэлектрическому эффекту - генерированию потенциалов в местах контакта кристаллов минерального вещества кости гидроксиаппатита с органическим веществом - коллагеном. Возникающие электрические потенциалы способствуют движению ионов и молекул по питающим костную ткань каналам. Прекращение механических нагрузок обычно ведет к атрофии кости от бездеятельности. Это связано с нарушениями кровообращения, электрохимических потенциалов и преобладанием процессов деструкции над процессами образования костной ткани. Одной из новых разновидностей этого явления стала потеря кальция костной тканью в условиях невесомости при космических полетах. Напротив, при постоянных избыточных нагрузках формируется рабочая гипертрофия кости.
Регуляция роста костей осуществляется гормонами - соматотропином, гормонами щитовидной и половых желез, а также соматомединами или инсулиноподобными факторами роста (ИПФ), один из которых образуется в печени под влиянием соматотропина (ИПФ1), а другой - (ИПФ2) - самими хондроцитами хрящевой зоны роста (рис.14.1). При этом соматотропин способствует образованию чувствительных к ИПФ 1 хондроцитов из клеток предшественников, а в дальнейшем, под влиянием ИПФ1 происходит пролиферация хондроцитов и образование гипертрофированных клеток, уже способных к оссификации (рис. 14.2). Рост и дифференцировку остеобластов стимулирует и гормон кальцитриол, основная функция которого заключается в регуляции процессов минерализации.
Наряду с постоянной физиологической регенерацией, костная ткань обладает способностью к сепаративной регенерации, т.е. восстановлению структуры и функции после повреждения (перелома). Репаративная регенерация реализуется теми же элементами костной ткани, которые обеспечивают рост и обновление костной структуры - хондроцитами и стволовыми остеогенными клетками надкостницы, соединительнотканными клетками межбалочных пространств губчатого вещества и сосудистых каналов остеонов, остеобластами. Остеоциты в регенерации не участвуют. Остеокласты стимулируют регенерацию гуморальными факторами.
Раньше всего в процесс регенерации включаются клетки надкостницы, образующие быстро растущую хрящевую ткань, что обеспечивает формирование периостальной (наружной) костной мозоли, способствующей фиксации костных отломков и их обездвиживанию. Регенерация также происходит со стороны костномозговой полости, приводя к образованию эндостальной костной мозоли. Последняя играет большую роль при переломах эпифизарных частей трубчатых костей, состоящих из губчатой ткани с малым числом ростовых клеток надкостницы. В подобных случаях мозоль образуется из клеток межбалочных пространств.
Состояние покоя в области перелома облегчает процесс формирования костной мозоли в межотломковой щели (интермедиарная мозоль), завершающей сращение перелома. Кровеносные сосуды прорастают в щель перелома вместе с остеогенной тканью, как со стороны надкостницы, так и из эндооста. Образовавшаяся костная мозоль с помощью остеобластов постепенно перестраивается, приобретая типичное для костной ткани трабекулярное или остеонное строение. Регенерация кости не является лишь местным процессом, а сопровождается общими изменениями минерального и белкового обмена, функций эндокринных желез и других физиологических процессов в организме.
Минерализация кости, т.е. отложение неорганических веществ в ранее образованный органический матрикс, осуществляется с учас Рис. 14.1. Схема гормональной регуляции роста костей в длину. СТЛ - соматолиберин, СТС - соматостатин, ИПФ2 - инсулиноподобный фактор роста хрящевого происхождения, (+) - активация, () - ингибирование; штриховая стрелка - реализация инсулиноподобных эффектов.
тием коллагена как каркаса. При этом минеральные кристаллы включаются внутрь коллагеновых фибрилл и скрепляются с ними с помощью протеогликанов. Основным минеральным соединением фосфата кальция в кости является гидрокеиаппатит, образующий микрокристаллы с огромной суммарной поверхностью - до 100 га. Сильное электростатическое поле кристалла удерживает вокруг него гидратную оболочку, играющую основную роль в обмене ионами Рис.14.2. Прямой и опосредованный эффекты соматотропина (СТГ).
ИПФ1 - инсупиноподобный фактор роста.
между кристаллами и внеклеточной жидкостью. В микрокристаллы кроме кальция и фосфора включаются и другие ионы - карбонат, нитрат, натрий, калий, магний, фтор, свинец, стронций и т.п.
Процесс минерализации кости состоит в образовании остеобластами или хондробластами мембранных везикул, отпочковывающихся во внеклеточное пространство. В везикулах содержится много фосфолипидов и щелочная фосфатаза. Везикулы захватывают и накапливают кальций и фосфор, после чего первично образуется фосфат кальция, преобразуемый затем в гидроксиаппатит с участием щелочной фосфатазы. Благодаря наличию в везикулах фосфолипидов, начинается непрерывный рост кристаллов оксиаппатита, продолжающийся и после разрыва пузырька. Щелочная фосфатаза взаимо действует с коллагеном, структура которого способствует упорядочиванию пролиферации кристаллов.
Процессы минерализации и деминерализации кости обеспечивают гомеостазис кальция и фосфора в организме и регулируются тремя кальцийрегулирующими гормонами - паратирином, кальцитонином и кальцитриолом (см.главу 5).
Содержание в костной ткани больших количеств кальция и фосфора, а также непрерывность сопряженных процессов образования и разрушения ткани позволяют говорить о том, что костная ткань выполняет резсрвуарнодепонирующую функцию по отношению к этим ионам. Действительно, 99% из почти 2 кг содержащегося в организме кальция и 87% всего фосфора находится в костной ткани и может быть легко мобилизовано из нее в кровь. Таким образом, содержание кальция в крови, а следовательно его уникальная физиологическая роль в регуляции жизнедеятельности многочисленных клеток, зависят от особенностей постоянно происходящего обмена кальция между кровью и костной тканью. Кальций и фосфор являются для организма настолько необходимыми элементами, что резервуарнодепонирующую функцию можно даже считать основной функцией костной ткани.
Резервуарнодепонирующую функцию кость выполняет не только в отношении кальция и фосфора, но и для других макро и микроэлементов. Так, в костной ткани содержится 50% всего магния и 46% всего натрия организма. Все элементы, избирательно накапливающиеся в костной ткани, можно разделить на две группы - 1) участвующие в ионном обмене, равномерно распределенные в минеральной фазе кости (Са, Sr, Ba, Ra, P, F, Nb, Mg, Na) и 2) поступающие путем коллоидной адсорбции, скапливающиеся в эндоосте, периосте и плохо проникающие в минеральное вещество (Y, La, Zr, Th, Ac.
Способность костной ткани при образовании микрокристаллов минерального вещества заменять в кристаллической решетке оксиаппатита ионы кальция на другие, так называемые остеотропные микроэлементы, лежит в основе функции кости как ловушки для попадающих в организм ионов. Это проявляется не только в отношении свинца, обычно конкурирующего с кальцием в биологических субстратах, но и радиоактивных элементов, прежде всего стронция90. Связывание и концентрирование стронция в костной ткани является, с одной стороны, защитным процессом, так как изотоп элиминируется из внутренней среды. Но с другой стороны, накопление в костной ткани радиоактивного элемента ведет к прицельному облучению костного мозга, наиболее чувствительной ткани к действию ионизирующей радиации. Поскольку образующиеся при построении участка костной ткани минеральные кристаллы сохраняются до момента разрушения этого участка при обновлении кости, постольку радиоактивные элементы, включенные в минеральное вещество костной ткани, сохраняются в нем очень долгое время.
